Производство неконцентрированной азотной кислоты
Рефераты по химии / Производство неконцентрированной азотной кислотыСтраница 5
![]() (3.7.)
(3.7.)
В интегральной форме, наиболее часто применяемой для расчетов, эта зависимость имеет вид:
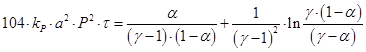 (3.8.)
(3.8.)
где kP–константа скорости реакции, МПа-2; Р– общее давление, МПа; g=b/a; b– начальная концентрация кислорода; a– степень окисления (а, b, a–в долях единицы).
Решение уравнения (3.8.) достаточно трудоемко, поэтому на практике чаще пользуются различными номограммами (рис. 3.1.) [2], уравнениями упрощенного типа или ЭВМ.
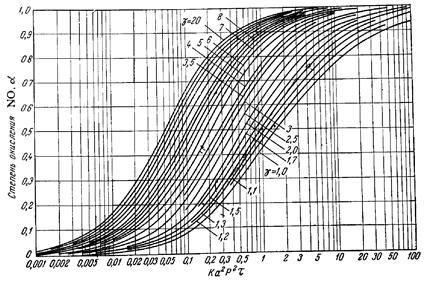
Рис. 3.1. Номограмма В.А. Каржавина для определения степени окисления оксида азота.
Неоднократно для увеличения скорости реакции окисления оксида азота (II) предпринимались попытки подобрать катализаторы. Работы проводились как при низких концентрациях NО (в целях сокращения абсорбционных объемов), так и при относительно высоких концентрациях (для увеличения скорости абсорбции и рекуперации энергии).
Многие оксиды металлов и другие вещества, обладающие высокой поверхностью и пористостью, проявляют каталитическую активность к реакции (3.1.). Однако практического применения исследованные контакты пока не нашли. Причиной этого является отрицательное влияние паров воды на скорость реакции окисления оксида азота (II) при температурах ниже 100 °С и параллельно протекающие процессы образования азотной кислоты в газовой фазе [1-3].
Установлено [1-3], что оксид азота (II) в определенных условиях, в том числе и в характерных для производства азотной кислоты, окисляется в жидкой фазе растворенным в ней кислородом. Например, при барботажном режиме скорость окисления NО увеличивается с повышением концентраций кислоты и оксидов азота и с ростом скорости газового потока. В отличие от процесса в газовой фазе скорость окисления NО в жидкости возрастает с повышением температуры. Она увеличивается при повышении концентрации кислоты примерно до 50% НNО3, затем снижается. Максимальная степень окисления наблюдается при температуре 30–40 °С. Однако, оценивая все эти особенности, следует учитывать, что скорость окисления в жидкой фазе значительно ниже, чем в равных условиях в газовой фазе. Предполагают [1], что степень окисления оксида азота (II) в жидкой фазе составляет 12–15% от общей степени окисления в нижней части абсорбционной колонны и 2,5–3% на верхней части.
С появлением в газе NО2 при температурах ниже 150–200оС начинают протекать реакции (3.2.) и (3.3.). Константа равновесия реакции (3.2.) может быть вычислена с большой точностью по следующей формуле (для давления в МПа):
![]() (3.9.)
(3.9.)
Имеются сведения, что Кр этой реакции зависит не только от температуры, но и от концентрации оксидов азота в газе [1, 3]. В соответствии с равновесием реакции (3.2.) степень полимеризации оксида азота (IV) увеличивается при понижении температуры, повышении давления и концентрации оксидов азота в газе.
При низких температурах и повышенных давлениях равновесие реакции (1.2.) практически полностью сдвинуто в сторону образования N2O4. Например, степень полимеризации (X) чистого диоксида азота составляет:
|
Температура, оС |
-20 |
0 |
10 |
30 |
70 |
100 |
150 |
|
Х, % |
92 |
89 |
87 |
77,8 |
38,4 |
12,5 |
1,4 |
Информация о химии
Гидрирование на отдельных атомах
Результаты исследования, проведенного в Университете Тафтса, говорят о том, что наночастицы меди, на поверхности которых расположены отдельные атомы палладия, могут играть роль эффективных катализаторов гидрирования органических с ...
Умения - компонент развивающего обучения
Классификация умений Ценностным компонентом развивающего рационального обучения химии являются умения, так как с одной стороны, знания формируются в деятельности, а с другой – умения сами являются важнейшим элементом э ...
Po — Полоний
ПОЛОНИЙ (лат. Polonium), Ро, химический элемент VI группы периодической системы Менделеева, атомный номер 84, атомная масса 208,9824. Свойства: радиоактивен; наиболее устойчивый изотоп 209Ро (период полураспада 102 часа). Мягкий ...


