Производство неконцентрированной азотной кислоты
Рефераты по химии / Производство неконцентрированной азотной кислотыСтраница 4
С водой азотная кислота смешивается в любых соотношениях с выделением большого количества тепла (493,7 кДж/кг) при получении бесконечно разбавленного раствора.
Свойства, характеризующие пожаро– взрывоопасность и токсичность неконцентрированной азотной кислоты приводятся в разделе 11 «Основные правила безопасной эксплуатации производства» настоящего регламента.
Область применения
Азотная кислота неконцентрированная применяется на предприятии для производства минеральных удобрений.
3. Технологическая часть
3.1 Теоретические основы процесса
При каталитическом окислении аммиака образуется лишь оксид азота (II) (NО). Это относительно мало реакционноспособное соединение, не реагирующее с водой, поэтому для получения азотной кислоты оно должно быть окислено до оксидов высших валентностей.
При окислении NО кислородом образуется диоксид азота,
2NO+О2=2NO2,DrН0(298)=-113,6 кДж (3.1.)
который может полимеризоваться до N2О4 и взаимодействовать с NО с образованием оксида азота (III) [1-3]:
2NO2 = N2О4 DНr(298)=- 55,8 кДж (3.2.)
NO+NO2=N2О3 DНr(298)=-40,5 кДж (3.3.)
Равновесие этих реакций при низких температурах смещено вправо, поэтому в нитрозном газе в условиях избытка кислорода и при достаточном времени контактирования все оксиды азота после охлаждения могут быть превращены в оксид азота (IV) (NО2). В реальных условиях непрерывно протекающих процессов окисления и кислотообразования равновесие не достигается, поэтому в газах присутствуют все указанные оксиды азота– NO, NО2, N2O3, N2О4. Соотношение между их количествами определяется в основном температурными условиями.
Равновесие и скорость окисления оксида азота II
Равновесие реакций (3.1.–3.3.) хорошо изучено, и числовые значения констант равновесия могут быть найдены практически в любом химическом справочнике.
Температурная зависимость константы равновесия реакции (3.1.) может быть вычислена с большой степенью точности по уравнению Боденштейна (для давления, выраженного в Па) [1-3]:
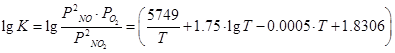 (3.4)
(3.4)
С понижением температуры равновесие реакции сдвигается в сторону образования оксида азота (IV). При атмосферном давлении в нитрозных газах, полученных конверсией аммиака воздухом, при температуре около 150°С в газе должен находиться один NO2, при 700 оС– один оксид азота (II) (NО). Повышение давления сдвигает равновесие в сторону образования NO2.
Особенностью реакции (3.1.) является то, что скорость ее имеет отрицательный температурный градиент– она увеличивается с понижением температуры. Объяснение этому противоречащему обычным закономерностям явлению находят в двухстадийности процесса. Вначале считали, что промежуточным продуктом окисления является димер оксида азота (N2O2). Позднее спектрально было установлено существование соединения NO3 в газах при окислении оксида азота (II). Большинство исследователей стало представлять процесс в целом как двухстадийный в виде [1-3]:
NO+O2=NO3DНr(298)=- 19,1 кДж (3.5.)
NO3+NO=2NO2DНr(298)=- 94,4 кДж (3.6.)
Первая стадия протекает быстро, с повышением температуры, скорость ее увеличивается, но равновесие смещается влево. Вторая стадия– медленная. Она и определяет скорость суммарного процесса. Поскольку при понижении температуры будет возрастать количество NO3, это приводит к увеличению скорости второй стадии и реакции в целом. Такой механизм позволяет объяснить отрицательный температурный градиент скорости реакции, однако в литературе отсутствуют данные о наличии NO3 в газе в результате диссоциации NO2 при высоких температурах, что должно было бы наблюдаться, если вторая стадия является равновесной.
Как установлено Боденштейном, окисление оксида азота (II) протекает по уравнению третьего порядка. Пренебрегая скоростью диссоциации оксида азота (IV), что вполне правомерно до температур примерно 300 °С, изменение скорости реакции (3.1.) через парциальные давления можно выразить уравнением:
Информация о химии
Классификация по атомному весу
Со времен Дальтона до 1860 в химии не было точного определения понятия атомного веса. Система, основанная на «эквивалентных весах», предложенная английским химиком Уильямом Волластоном (1766–1828), опиралась на с ...
Пруст (Proust), Жозеф Луи
Французский химик Жозеф Луи Пруст родился в небольшом городке Анжере в семье аптекаря. Получив химическое образование в Парижском университете, в 1775 г. он был назначен на должность управляющего аптекой больницы Сальпетриер. В 17 ...
Химия почв
Химия почв — это раздел почвоведения, изучающий химические основы почвообразования и плодородия почв. Основой для решения этих вопросов служит исследование состава, свойств почв и протекающих в почвах процессов на ионно-мол ...


