Радикальная сополимеризация акрилат- и метакрилатгуанидинов с виниловыми мономерами
Рефераты по химии / Радикальная сополимеризация акрилат- и метакрилатгуанидинов с виниловыми мономерамиСтраница 6
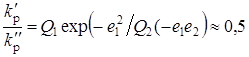 ,
,
где Q1 =2,34; e1 = 0,65 – константы для МАК.
Q2 = 1,36; e2 = –1,18 – для метакрилатаниона.
В действительности же, по данным работы [21], как видно, отношение констант равно лишь 0.5, а скорость полимеризации МАК в интервале рН = 2,5-5,5 падает примерно в 5 раз, т. е. экспериментальный результат не удается объяснить только различием классических параметров реакционной способности «сомономеров».
Причина наблюдаемого резкого уменьшения константы скорости роста цепей с увеличением рН от 2 до 6, как считают авторы [19-21], состоит в том, что по мере ионизации МАК концентрация сильно гидратированных метакрилат-анионов в относительно гидрофобных незаряженных клубках макрорадикалов ПМАК оказывается ниже их средней концентрации в растворе и, в то же время, в кислых средах можно ожидать преимущественной сорбции МАК в клубках ПМАК, т.е. повышения концентрации мономера в микрообластях, окружающих активные центры.
Интересные результаты о существенном влиянии природы катиона на эффективность константы сополимеризации в системе АК – акриламид в водных растворах приводились в работе Войнаровского и др. [28, 29], которые показали, что содержание звеньев акриловой кислоты в сополимере уменьшаются в ряду Li+ > Na+ > K+.
Обнаруженные эффекты авторы связали с электростатическими взаимодействиями заряженных макрорадикалов и противоионов (катионов металлов), отметив при этом, что чем сильнее заряженные макрорадикалы (звенья акрилатанионов) способны к связыванию с катионами металла, тем в меньшей степени электростатические отталкивания препятствуют присоединению акрилатанионов в актах роста цепей.
Ранее Крещенцев и др. [20] показали, что при связывании «мертвой» полиакриловой кислоты с ионами металлов степень ионного связывания изменяется в таком же порядке Li+ > Na+ > K+, уменьшаясь с возрастанием радиуса катиона.
Регулирование рН растворов добавлением аминов. Особый интерес представляют данные по изучению влияния на процесс полимеризации рассматриваемых мономеров различных нейтрализующих агентов, в том числе органических аминов, основность и строение которых можно широко варьировать.
Основные результаты исследования таких систем были получены в работах Топчиева, Кабанова и сотр. [9-20]. В качестве нейтрализующих агентов были выбраны при проведении кинетических исследований полимеризации МАК – изобутиламин (ИБА), этилендиамин (ЭДА), триэтиламин (ТЭА) и гидроокись аммония; при полимеризации АК – ТЭА и NH4OH. Было установлено, что во всех указанных системах сохраняется половинный порядок по инициатору (ДАК). По мономеру - при полимеризации МАК - установлен первый порядок, а полуторный порядок, при полимеризации АК. Было также показано, что скорость распада инициатора ДАК при полимеризации МАК не зависит от природы нейтрализующего агента и практически постоянна в исследованном интервале значений рН реакционных растворов [15].
Учитывая обнаруженную ранее особенность поведения акриловой кислоты, которая в отличие от МАК, характеризуется относительно высокой способностью к присоединению первичных и вторичных органических аминов по реакции Михаэля [30-32], при изучении полимеризации АК в воде в зависимости от рН был выбран ТЭА, влияние которого на кинетику полимеризации сравнивали с влиянием аммиака [15, 16, 19, 20].
Ход зависимости полимеризации АК и МАК от рН реакционного раствора имеет сложный характер. В области рН = 2-4,5 природа нейтрализующих агентов, как видно, практически не влияет на скорость полимеризации, и их роль, по мнению авторов [20], сводится только к ионизации мономера. С ростом рН происходит увеличение содержания метакрилат(акрилат)аниона (причины падения скорости полимеризации АК и МАК с ростом рН уже были обсуждены выше), а растущие полимерные цепи в рассматриваемом интервале рН не ионизованы.
При больших рН (5-10) зависимость скорости полимеризации МАК в случае добавления в реакционную систему ЭДА или NH4OH проходит через экстремум. Для системы МАК–ЭДА максимум скорости наблюдается при рН = 6,6, когда макрорадикалы ПМАК преимущественно еще не ионизованы (константы диссоциации ЭДА равны: рКa1 = 7,0; рКа2 = 10,0). Авторами было высказано предположение, что неионизованные аминогруппы ЭДА, присутствующие в реакционных растворах, в этих условиях способны, по-видимому, образовывать ассоциаты с неионизованными карбоксильными группами на концах растущих цепей. В таком случае переходное состояние в акте роста цепи для данной системы можно представить следующим образом (схема 2).
Информация о химии
Форма микролинз контролируется уровнем pH
Исследователи из Китая использовали обычный белок для создания оптических линз, диаметр которых составляет десятые доли микрометра. Фокусировка таких линз может изменяться просто за счет изменения значения pH окружающей среды. Ис ...
Лелуар (Leloir), Луис Федерико
Аргентинский биохимик Луис Федерико Лелуар родился в Париже, когда его родители, Федерико Лелуар и Ортенсиа (Агуирре) Лелуар, совершали поездку во Францию. Мальчику исполнилось два года, и семья Лелуаров возвратилась в Буэнос-Айре ...
Uub — Ununbium (Унунбиум)
УНУНБИУМ (Унунбий) (лат. Ununbium), Uub, химический элемент II группы периодической системы, атомный номер 112, атомная масса [285], наиболее устойчивый изотоп 285Uub. Свойства: радиоактивен. Металл, повидимому находится в жидком ...


