Радикальная сополимеризация акрилат- и метакрилатгуанидинов с виниловыми мономерами
Рефераты по химии / Радикальная сополимеризация акрилат- и метакрилатгуанидинов с виниловыми мономерамиСтраница 8
В качестве вероятных причин объясняющих аномальный ход кривой скорости полимеризации МАК, авторы рассматривают возможное влияние присутствующих в водном растворе линейных димеров МАК, о которых сообщалось в ряде работ [34, 35]. При этом было установлено, что в водных растворах карбоновых кислот имеются линейные димеры (схема 3), тогда как в неполярных растворителях присутствуют циклические димеры [36].
Схема 3
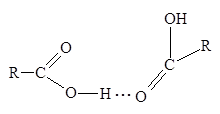
Увеличение скорости полимеризации МАК при рН = 3-4, сопровождаемое помутнением системы и выпадением полимера, обуславливается образованием донорно-акцепторного комплекса между ионизованным димером МАК (в котором система сопряженных связей играет роль донора электронов) и ионом пиридиния (акцептором электронов), который стабилизован гидрофобными взаимодействиями (схема 4).
Схема 4
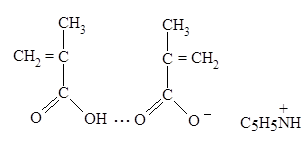
В образовавшемся комплексе происходит перераспределение электронной плотности на двойных связях, что может привести к химической активации димера. Увеличение рН раствора до 5-6 приводит к ионизации второй молекулы мономера входящей в димер и, следовательно, приводит к разрушению комплекса и к резкому падению скорости полимеризации. Константы ионизации таких димеров выше констант ионизации соответствующих мономерных кислот. Основная роль в стабилизации линейных димеров принадлежит гидрофобным взаимодействиям алкильных групп [35].
Роль гидрофобных взаимодействий в рассматриваемом процессе была показана также при изучении кинетики полимеризации другой непредельной кислоты АК в водных растворах, рН которых были установлены добавление NaOH и пиридина. Известно, что гидрофобность АК существенно менее выражена, чем гидрофобность МАК. Оказалось, что изменение скорости полимеризации АК в интервале рН = 2-6 мало зависит от природы нейтрализующего агента, т.е. в присутствии пиридинийионов не происходит ускорения полимеризации АК.
В результате проведенных исследований данного явления, авторы заключили, что в рассмотренной системе реализуется случай взаимодействия саморегулирующегося активатора – пиридинийиона – с димером МАК, в результате чего образуется комплекс с более высокой реакционной способностью, чем у МАК.
Таким образом рассмотренные в данном разделе результаты изучения кинетики полимеризации метакрилат- и акрилатанионов в водных растворах оснований и органических аминов свидетельствуют о весьма слабом влиянии природы нейтрализующего агента на зависимость начальной скорости полимеризации непредельных кислот от рН реакционного раствора. В соответствии с выдвинутой гипотезой авторы [20] рассматривают это явление как результат специфичного влияния природы ионных пар на константу скорости роста цепи при полимеризации и растущий радикал ионизованной поликислоты-поликатиона, либо образованием комплекса ионизованных мономеров в водных средах (например, система МАК – пиридин).
1.2 Полимеризация непредельных кислот в водных и органических средах
В предыдущих разделах рассматривались основы кинетических закономерностей и особенностей реакции радикальной полимеризации мономеров акрилового ряда в водных растворах с изменением рН в присутствии различных нейтрализующих агентов. Анализ представленных литературных данных позволяет заключить, что обнаруженные кинетические особенности, главным образом, являются следствием специфических взаимодействий заряженных макрорадикалов и присутствующих в реакционном растворе низкомолекулярных противоионов.
Представляется также несомненно важным оценить влияние природы реакционной среды на процесс полимеризации рассматриваемых мономеров, в частности провести сравнительный анализ кинетических данных при полимеризации акриловых кислот в органических растворителях и в водных растворах. Данной проблеме посвящено значительное количество публикаций [37-43].
Известно, что при радикальной полимеризации непредельных кислот в органических растворителях важную роль играет электронодонорная способность растворителей, а, следовательно, степень сольватации мономера в реакционной системе. Для димерной формы непредельных кислот характерно большее значение Q1, т.е. большая реакционноспособность в рамках схемы Q–е, поскольку димерная форма характеризуется большей энергией стабилизации двойной связи по сравнению с мономерной.
Информация о химии
Md — Менделевий
МЕНДЕЛЕВИЙ (лат. Mendelevium), Md, химический элемент III группы периодической системы Менделеева, атомный номер 101, атомная масса 258,0986; относится к актиноидам. Свойства: радиоактивен, наиболее устойчивый изотоп 258Md (перио ...
Hg — Ртуть
РТУТЬ (лат. Hydrargyrum), Hg, химический элемент II группы периодической системы, атомный номер 80, атомная масса 200,59. Свойства: серебристый жидкий металл. Плотность 13,5 г/м2 (тяжелее всех известных жидкостей), tпл= –38 ...
Штерн (Stern), Отто
Немецко-американский физик Отто Штерн родился в Сорау (ныне Зори, Польша) и был старшим из пяти детей Оскара Штерна и Евгении Штерн (в девичестве Розенталь). Родители Штерна происходили из богатых семей, составивших состояния на м ...


