Радикальная сополимеризация акрилат- и метакрилатгуанидинов с виниловыми мономерами
Рефераты по химии / Радикальная сополимеризация акрилат- и метакрилатгуанидинов с виниловыми мономерамиСтраница 6
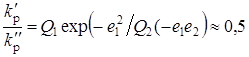 ,
,
где Q1 =2,34; e1 = 0,65 – константы для МАК.
Q2 = 1,36; e2 = –1,18 – для метакрилатаниона.
В действительности же, по данным работы [21], как видно, отношение констант равно лишь 0.5, а скорость полимеризации МАК в интервале рН = 2,5-5,5 падает примерно в 5 раз, т. е. экспериментальный результат не удается объяснить только различием классических параметров реакционной способности «сомономеров».
Причина наблюдаемого резкого уменьшения константы скорости роста цепей с увеличением рН от 2 до 6, как считают авторы [19-21], состоит в том, что по мере ионизации МАК концентрация сильно гидратированных метакрилат-анионов в относительно гидрофобных незаряженных клубках макрорадикалов ПМАК оказывается ниже их средней концентрации в растворе и, в то же время, в кислых средах можно ожидать преимущественной сорбции МАК в клубках ПМАК, т.е. повышения концентрации мономера в микрообластях, окружающих активные центры.
Интересные результаты о существенном влиянии природы катиона на эффективность константы сополимеризации в системе АК – акриламид в водных растворах приводились в работе Войнаровского и др. [28, 29], которые показали, что содержание звеньев акриловой кислоты в сополимере уменьшаются в ряду Li+ > Na+ > K+.
Обнаруженные эффекты авторы связали с электростатическими взаимодействиями заряженных макрорадикалов и противоионов (катионов металлов), отметив при этом, что чем сильнее заряженные макрорадикалы (звенья акрилатанионов) способны к связыванию с катионами металла, тем в меньшей степени электростатические отталкивания препятствуют присоединению акрилатанионов в актах роста цепей.
Ранее Крещенцев и др. [20] показали, что при связывании «мертвой» полиакриловой кислоты с ионами металлов степень ионного связывания изменяется в таком же порядке Li+ > Na+ > K+, уменьшаясь с возрастанием радиуса катиона.
Регулирование рН растворов добавлением аминов. Особый интерес представляют данные по изучению влияния на процесс полимеризации рассматриваемых мономеров различных нейтрализующих агентов, в том числе органических аминов, основность и строение которых можно широко варьировать.
Основные результаты исследования таких систем были получены в работах Топчиева, Кабанова и сотр. [9-20]. В качестве нейтрализующих агентов были выбраны при проведении кинетических исследований полимеризации МАК – изобутиламин (ИБА), этилендиамин (ЭДА), триэтиламин (ТЭА) и гидроокись аммония; при полимеризации АК – ТЭА и NH4OH. Было установлено, что во всех указанных системах сохраняется половинный порядок по инициатору (ДАК). По мономеру - при полимеризации МАК - установлен первый порядок, а полуторный порядок, при полимеризации АК. Было также показано, что скорость распада инициатора ДАК при полимеризации МАК не зависит от природы нейтрализующего агента и практически постоянна в исследованном интервале значений рН реакционных растворов [15].
Учитывая обнаруженную ранее особенность поведения акриловой кислоты, которая в отличие от МАК, характеризуется относительно высокой способностью к присоединению первичных и вторичных органических аминов по реакции Михаэля [30-32], при изучении полимеризации АК в воде в зависимости от рН был выбран ТЭА, влияние которого на кинетику полимеризации сравнивали с влиянием аммиака [15, 16, 19, 20].
Ход зависимости полимеризации АК и МАК от рН реакционного раствора имеет сложный характер. В области рН = 2-4,5 природа нейтрализующих агентов, как видно, практически не влияет на скорость полимеризации, и их роль, по мнению авторов [20], сводится только к ионизации мономера. С ростом рН происходит увеличение содержания метакрилат(акрилат)аниона (причины падения скорости полимеризации АК и МАК с ростом рН уже были обсуждены выше), а растущие полимерные цепи в рассматриваемом интервале рН не ионизованы.
При больших рН (5-10) зависимость скорости полимеризации МАК в случае добавления в реакционную систему ЭДА или NH4OH проходит через экстремум. Для системы МАК–ЭДА максимум скорости наблюдается при рН = 6,6, когда макрорадикалы ПМАК преимущественно еще не ионизованы (константы диссоциации ЭДА равны: рКa1 = 7,0; рКа2 = 10,0). Авторами было высказано предположение, что неионизованные аминогруппы ЭДА, присутствующие в реакционных растворах, в этих условиях способны, по-видимому, образовывать ассоциаты с неионизованными карбоксильными группами на концах растущих цепей. В таком случае переходное состояние в акте роста цепи для данной системы можно представить следующим образом (схема 2).
Информация о химии
Gd — Гадолиний
ГАДОЛИНИЙ (лат. Gadolinium), Gd, химический элемент III группы периодической системы, атомный номер 64, атомная масса 157,25, относится к лантаноидам. Свойства: металл, плотность 7,895 г/см3, tкип 1312 °С. Ферромагнетик (ниже ...
Вааге (Waage), Петер
Норвежский химик Петер Вааге (правильнее – Воге) родился в г. Флеккефьорд. Изучал медицину и минералогию в университете Кристиании (ныне Осло); после окончания университета изучал химию в Германии и Франции. Вернувшись в Нор ...
Ган (Hahn), Отто
Немецкий химик Отто Ган родился во Франкфурте-на-Майне и был одним из трех сыновей Генриха Гана, стекольщика, и Шарлотты Гизе (в девичестве Штуцман) Ган. После получения начального образования в Клингерском реальном училище Ган по ...


