Производство неконцентрированной азотной кислоты
Рефераты по химии / Производство неконцентрированной азотной кислотыСтраница 17
Расчет материального баланса процесса окисления нитрозного газа
Равновесие и скорость окисления оксида азота II.
NO+1/2O2=NO2 ΔrH(298) =112кДж/моль (3.1)
Зависимость константы равновесия от температуры по данным М. Боденштейна [3] выражается следующим уравнением:
LgK =Lg![]() +1,75LgT-0,0005T+2,839 (3.2)
+1,75LgT-0,0005T+2,839 (3.2)
Для расчета равновесной степени окисления оксида азота (II) выразим парциальные давления газов, входящие в уравнение равновесия, через общее давление в зависимости от начальной концентрации газа[3]:
Введем обозначения:
2a- начальная концентрация NO, мольн.доли;
b- начальная концентрация O2, мольн.доли;
xр- равновесная степень окисления NO, доли единицы;
Робщ- общее давление газа, атм.
Равновесные концентрации компонентов газовой смеси согласно реакции (3.1)составят:
|
Компонент |
Вход |
Выход |
|
NO |
2a |
2а(1-xp) |
|
O2 |
b |
b-axp |
|
NO2 |
- |
2axp |
|
Всего: |
1 |
1-axp |
Тогда парциальные давления компонентов газа при общем давлении 3,6 атм.в момент равновесия будут равны:
PNO=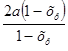 Pобщ;
Pобщ;
РO2=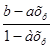 Pобщ;
Pобщ;
РNO2=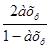 Pобщ;
Pобщ;
Подставляя значения парциальных давлений в уравнение равновесия, получим:
![]() =
=![]() P (3.3)
P (3.3)
Определим равновесную степень окисления оксида азота (II) для газа, содержащего 3,09% NO и 3,57% (об) O2 при 3,6 атм.
Тогда 2a=0,0309 м.д. a=0,01545м.д. b=0,0357м.д.
LgKр =−![]() +1,75lg403-0,0005
+1,75lg403-0,0005![]() 403+2,839
403+2,839
Откуда Кр=8,546![]()
Подставляя значения Кр и парциальных давлений в уравнение (3.3)получим:
![]()
![]()
Из этого уравнения определяем ![]() .
.
В результате протекания реакции (3.1) окисляется оксида азота (II):
VNO![]() Х=
Х=![]() ;
;
Остается NO:
![]() ;
;
Расходуется кислорода на окисление
![]() ;
;
Остается кислорода:
![]() ;
;
Содержание NO2 в нитрозном газе на выходе из аппарата:
![]() ;
;
Результаты расчета материального баланса процесса окисления представлены в таблице 3.1.
Таблица 3.1
Равновесный состав газовой смеси.
|
Приход |
Расход | ||||||||
|
Компонентный состав |
нм3/т |
% об |
кг/т |
% масс |
Компонентный состав |
нм3/т |
% об |
кг/т |
% масс |
|
Нитрозный газ, в т.ч. |
3789,17 |
100,00 |
3984,21 |
100,00 |
Нитрозный газ, в т.ч. |
3730,64 |
100,00 |
4150,4 |
100,00 |
|
NO |
117,05 |
3,09 |
223,63 |
5,61 |
NO |
0,08 |
0,002 |
0,09 |
0,002 |
|
NO2 |
241,01 |
6,36 |
148,55 |
3,73 |
NO2 |
357,98 |
9,59 |
597,98 |
14,41 |
|
O2 |
135,19 |
3,57 |
186,37 |
4,68 |
O2 |
76,66 |
2,05 |
126,66 |
3,05 |
|
N2 |
2691,38 |
71,03 |
3364,23 |
84,44 |
N2 |
2691,38 |
71,03 |
3364,23 |
81,05 |
|
H2O |
604,54 |
15,95 |
61,44 |
1,54 |
H2O |
604,54 |
15,95 |
61,44 |
1,48 |
|
Всего: |
3789,17 |
100,00 |
3984,21 |
100,00 |
Всего: |
3730,64 |
100,00 |
4150,4 |
100,00 |
Информация о химии
Ломоносов, Михаил Васильевич
Русский учёный Михаил Васильевич Ломоносов родился в селе Денисовка Архангельской губернии (ныне с. Ломоносово) в семье помора. В 1731 г. он поступает учиться в Славяно-греко-латинскую академию в Москве, выдав себя за дворянского ...
Gd — Гадолиний
ГАДОЛИНИЙ (лат. Gadolinium), Gd, химический элемент III группы периодической системы, атомный номер 64, атомная масса 157,25, относится к лантаноидам. Свойства: металл, плотность 7,895 г/см3, tкип 1312 °С. Ферромагнетик (ниже ...
Rg — Roentgenium (Рентгений)
РЕНТГЕНИЙ (лат. Roentgenium, бывший унунуний (unununium)), Rg, химический элемент I группы периодической системы, атомный номер 111, атомная масса [272], наиболее устойчивый изотоп 272Rg. Свойства: радиоактивен. Металл, повидимом ...


