Инструментальные методы анализа веществ
Рефераты по химии / Инструментальные методы анализа веществСтраница 3
![]() .
.
Или при 25°С:
![]()
При потенциометрическом титровании часто используют титрование не до определенного потенциала, а до определенной величины рН, например, до нейтральной среды рН=7. Несколько в стороне от общепринятых методов потенциометрического титрования (без протекания тока через электроды), рас смотренных выше, стоят методы потенциометрического титрования при постоянном токе с поляризующимися электродами. Чаще применяют два поляризующихся электрода, но иногда пользуются и одним поляризующимся электродом.
В отличие от потенциометрического титрования с неполяризующимися электродами, при котором ток через электроды практически не протекает, в данном случае через электроды (обычно платиновые) пропускается небольшой (около нескольких микроампер) постоянный ток, получаемый от источника стабилизированного тока. В качестве источника тока может служить высоковольтный источник питания (около 45 В) с последовательно включенным относительно большим сопротивлением. Измеряемая на электродах разность потенциалов резко возрастает при приближении реакции к эквивалентной точке вследствие поляризации электродов. Величина скачка потенциала может быть гораздо больше, чем при титровании при нулевом токе с неполяризующимися электродами.
Требования к реакциям при потенциометрическом титровании – это полнота прохождения реакции; достаточно большая скорость реакции (чтобы результаты не приходилось ждать, и была возможность автоматизации); получение в реакции одного четкого продукта, а не смеси продуктов, которые при различных концентрациях могут получаться.
Примеры реакций и соответствующие им электродные системы:
Окисление-восстановление:
![]() .
.
Система электродов:
![]() .
.
В обоих случаях используется система, которая состоит из платинового электрода и хлорсеребряного.
Осаждение:
Ag+ + Cl- =AgCl↓.
Система электродов:
![]() .
.
Комплексообразование:
![]()
Система электродов:
![]() .
.
Графические способы определения конечной точки титрования. Принцип заключается в визуальном изучении полной кривой титрования. Если начертить зависимость потенциала индикаторного электрода от объема титранта, то на полученной кривой имеется максимальный наклон – т.е. максимальное значение ДE/ДV – который можно принять за точку эквивалентности. Рис. 2.1, показывающий именно такую зависимость, построен по данным табл. 2.1.
Таблица 2.1 Результаты потенциометрического титрования 3,737 ммоль хлорида 0,2314 F раствором нитрата серебра
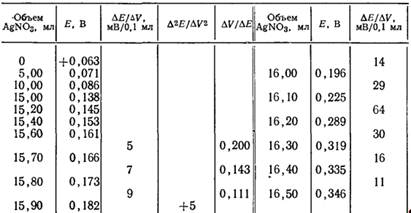
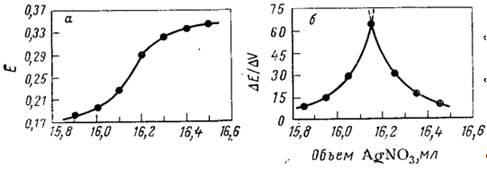
Рис. 2.1 Кривые титрования 3,737 ммоль хлорида 0,2314 F раствором нитрата серебра: а – обычная кривая титрования, показывающая область вблизи точки эквивалентности; б – дифференциальная кривая титрования (все данные из табл. 2.1)
Метод Грана. Можно построить график ДE/ДV – изменение потенциала на объем порции титранта как функцию объема титранта. Такой график, полученный из результатов титрования, приведенных в табл. 2.1, показан на рис. 2.2.
Информация о химии
Rn — Радон
РАДОН (лат. Radon), Rn, химический элемент VIII группы периодической системы, атомный номер 86, атомная масса 222,0176, относится к инертным, или благородным, газам. Свойства: радиоактивен. Наиболее устойчивый изотоп 222Rn (перио ...
Органическая химия
В течение всего 18 в. в вопросе о химических взаимоотношениях организмов и веществ ученые руководствовались доктриной витализма – учения, рассматривавшего жизнь как особое явление, подчиняющееся не законам мироздания, а влия ...
Агрикола (Agricola), Георг
24 марта 1490 г. – 21 ноября 1555 г. Георг АгриколаНемецкий учёный в области горного дела и металлургии Георг Агрикола [настоящая фамилия Бауэр (Bauer); лат. agricola – земледелец, перевод немецкого слова Bauer] родил ...


