Инструментальные методы анализа веществ
Рефераты по химии / Инструментальные методы анализа веществСтраница 5
Биамперометрическое титрование. Этот вид амперометрического титрования основан на использовании двух поляризуемых электродов – обычно платиновых, на которые подается небольшая разность потенциалов – 10–500 мВ. В этом случае прохождение тока возможно лишь при протекании обратимых электрохимических реакций на обоих электродах. Если хоть одна из реакций кинетически затруднена, происходит поляризация электрода, и ток становится незначительным.
Вольтамперные зависимости для ячейки с двумя поляризуемыми электродами приведены на рис. 3.2. В этом случае играет роль лишь разность потенциалов между двумя электродами. Значение потенциала каждого из электродов в отдельности остается неопределенным ввиду отсутствия электрода сравнения.
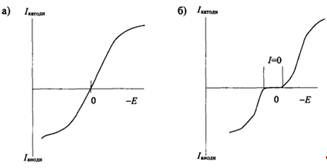
Рис 3.2 Вольтамперные зависимости для ячейки с двумя одинаковыми поляризуемыми электродами в случае обратимой реакции без перенапряжения (а) и необратимой реакции с перенапряжением (б).
В зависимости от степени обратимости электродных реакций можно получить кривые титрования различной формы.
а) Титрование компонента обратимой окислительно-восстановительной пары компонентом необратимой пары, например, иода тиосульфатом (рис. 3.3, а):
I2 + 2S2O32-![]() 2I- + S4O62-.
2I- + S4O62-.
До точки эквивалентности через ячейку протекает ток, обусловленный процессом:
2I- ![]() I2 + e-.
I2 + e-.
Ток возрастает вплоть до величины степени оттитрованности, равной 0,5, при которой оба компонента пары І2/І- находятся в одинаковых концентрациях. Затем ток начинает убывать вплоть до точки эквивалентности. После точки эквивалентности вследствие того, что пара S4O62-/S2O32- является необратимой, наступает поляризация электродов, и ток прекращается.
б) Титрование компонента необратимой пары компонентом обратимой пары, например, ионов As(III) бромом (рис. 3.3, б):
![]()
До точки эквивалентности электроды поляризованы, поскольку окислительно-восстановительная система As(V)/As(III) необратима. Через ячейку не протекает ток. После точки эквивалентности ток возрастает, поскольку в растворе появляется обратимая окислительно-восстановительная система Вr2/Вr-.
в) Определяемое вещество и титрант образуют обратимые окислительно-восстановительные пары: титрование ионов Fe(II) ионами Ce(IV) (рис. 3.3, в):
![]()
Здесь поляризации электродов не наблюдается ни на каком этапе титрования. До точки эквивалентности ход кривой такой же, как на рис. 3.3, а, после точки эквивалентности – как на рис. 3.3, б.
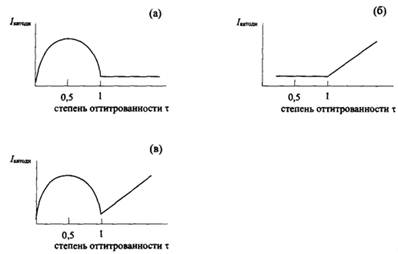
Рис. 3.3 Кривые биамперометрического титрования иода тиосульфатом (a), As(III) бромом (б) и ионов Fe(II) ионами Ce(IV) (в)
3.2 Задача: в электрохимическую ячейку с платиновым микроэлектродом и электродом сравнения поместили 10,00 смі раствора NaCl и оттитровали 0,0500 моль/дмі раствором AgNO3 объёмом 2,30 смі. Рассчитать содержание NaCl в растворе (%)
В растворе идет реакция:
Ag+ + Cl- =AgCl↓.
Тогда:
V(AgNO3) = 0,0023 (дм3);
n(AgNO3) = n(NaCl);
n(AgNO3)=c(AgNO3)•V(AgNO3)=0,0500•0,0023=0,000115,
или 1,15•104(моль).
n(NaCl) = 1,15•10-4 (моль);
Информация о химии
Tm — Тулий
ТУЛИЙ (лат. Thulium), Tm, химический элемент III группы периодической системы, атомный номер 69, атомная масса 168,9342, относится к лантаноидам. Свойства: металл. Плотность 9,318 г/см3, tпл 1545 °С. Название: от греческого ...
Штреккер (Strecker), Адольф Фридрих Людвиг
Немецкий химик-органик Адольф Фридрих Людвиг Штреккер родился в Дармштадте; в 1842 г. окончил Гисенский университет, где одним из преподавателей у него был Ю. Либих. Был учителем в гимназии Дармштадта; в 1846 г. стал ассистентом Л ...
Li — Литий
ЛИТИЙ (лат. Lithium), Li, химический элемент с атомным номером 3, атомная масса 6,941. Химический символ Li читается так же, как и название самого элемента. Литий встречается в природе в виде двух стабильных нуклидов 6Li (7,52% п ...


