Получение изопропанола
Рефераты по химии / Получение изопропанолаСтраница 9
NC=![]()
Вывод
: Расчет константы равновесия и равновесного состава показал, что к моменту равновесия израсходовалась много воды по сравнению с пропеном и следует повысить ее концентрацию.
6. Эмпирические методы расчета тепловых эффектов
При отсутствии справочных значении термодинамических функции для их нахождения используются эмпирические методы. В настоящее время известно большое количество методов расчетов термодинамических функции. Эти методы являются приближенными, они могут распространяться лишь на отдельные классы соединении, в определенном интервале параметров и т. д. Каждый из методов характеризуется своей погрешностью, иногда очень большой по сравнению с величиной, найденной экспериментально, поэтому к эмпирическим методам прибегают при отсутствии информационной базы.
Из данных для расчета материального баланса выбрать органические вещества и рассчитать ΔH0298,сгор по Коновалову и по Карашу. Для всех органических веществ рассчитать ΔH0298,обр по энергиям связи.
6.1 Расчет теплоты сгорания веществ по уравнению Коновалова
ΔHсгор=-(204,2n+44,4m+∑xi)
C3H6
C3H6+4.5O2=3CO2+H2O
ΔHсгор=-(204,2ּ9+44,4ּ3+87386)=-2058.86 кДж/моль
∆=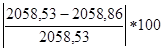 %=0,016%
%=0,016%
C3H8O
C3H8O +4,5O2=3CO2+4H2O
ΔHсгор =-(204,2ּ9+44,4ּ3+50.21)=-2021.21 кДж/моль
6.2 Расчет теплоты сгорания веществ по уравнению Караша
ΔHсгор=-26,05ּ(4C+H-P)+∑kiּ∆i
C3H6
ΔHсгор=-26,05ּ(4ּ3-2)=208.4 кДж/моль
C3H8O
ΔHсгор=-26,05ּ(4ּ3+8-2)+1(-13ּ4.18)=-523.24 кДж/моль
∆=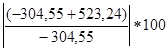 %=71.8%
%=71.8%
6.3 Расчет теплоты образования веществ по энергиям связи
ΔHобр=![]() νiּεi+
νiּεi+![]() niּQi―
niּQi―![]() νjּεj
νjּεj
C3H6
3C+3H2 = C3H6
ΔHобр=3Qвозг+3εH-H-(εC-C+6εC-H + εC=C )=3ּ 103.2ּ 4.18+3ּ 125ּ 4.18-(6ּ 4.18 85.6+62.8ּ 4.18+101.2ּ 4.18)=29.26 кДж/моль
∆=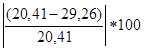 %=43.4%
%=43.4%
C3H8O
3C+4H2 +1/2O2= C3H8O
ΔHобр= 1/2εC=C +3Qвозг+4εH-H-(2εC=C+7εC-H+εC-O +εO-H )=1/2 ּ117.2 ּ4.18+3 ּ 125 4.18+4 ּ 103.2 ּ 4.18-(2 ּ 4.18 ּ 62.8+7 ּ 85.6 ּ 4.18+75 ּ4.18+110 ּ 4.18)=-265.012 кДж/моль
∆=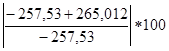 %=2.9%
%=2.9%
Вывод
: Таким образом в ходе расчетов установили, что теплота сгорания, расчитанная по уравнению Коновалова очень близка к табличному значению, следовательно данный метод расчета применим для данной реакции, а по уравнению Караша и расчеты по энэргиям связи дают большую погрешность и не применимы для реакции.
Выводы
Расчет практического материального баланса показал, что для получения 775,2 кг/ч целевого продукта(изопропанол) необходимо взять 752,64 кг/ч пропена и 967,68 кг/ч воды. Расчет показал, что закон сохранения масс выполняется.
Т.О.в ходе проведенных расчетов установлено, что для поддержания заданной температуры реакции необходимо подводить теплоту в количестве 588285,985 кДж/ч процент подводимого тепла невысокий (23,86%) отсюда для данного процесса температура выбрана оптимально. В ходе проведенных термодинамических расчетов установили, что данная химическая реакция в данном интервале температур (от 353 до 553 К) имеет H<0, следовательно реакция является экзоотермической.
В ходе химической реакции происходит уменьшение энтропии (S<0), следовательно тепловое (хаотичное) движение молекул уменьшается
Изменение изобарно-изотермического потенциала от 353 К до 553 К положительное, следовательно при заданном интервале реакция протекает самопроизвольно. С ростом температуры G увеличиваетсяся, значит реакцию следует проводить при пониженных температурах.
Расчет константы равновесия и равновесного состава показал, что к моменту равновесия израсходовалась много воды по сравнению с пропеном и следует повысить ее концентрацию.
Таким образом в ходе расчетов установили, что теплота сгорания, расчитанная по уравнению Коновалова очень близка к табличному значению, следовательно данный метод расчета применим для данной реакции, а по уравнению Караша и расчеты по энэргиям связи дают большую погрешность и не применимы для реакции.
Информация о химии
Уилкинс (Wilkins), Морис Хьюг Фредерик
Английский биофизик Морис Хьюг Фредерик Уилкинс родился в Понгароа (Новая Зеландия). Его мать, Эвелин (Виттейкер) Уилкинс, эмигрировала из Ирландии. Отца, Эдгара Генри Уилкинса, школьного доктора, очень привлекала исследовательска ...
Uuq — Ununquadium (Унунквадиум)
УНУНКВАДИУМ (Унунквадий) (лат. Ununquadium), Uuq, химический элемент IV группы периодической системы, атомный номер 114, атомная масса [289], наиболее устойчивый изотоп 289Uuq. Свойства: радиоактивен. Металл, повидимому находится ...
Физические методы дегазации воды
В технике водоподготовки для удаления газов (кроме кислорода) в основном применяют пленочные дегазаторы, а для обескислороживания воды — вакуумные дегазаторы или термические деаэраторы. Барботажные дегазаторы использую ...


