Получение изопропанола
Рефераты по химии / Получение изопропанолаСтраница 8
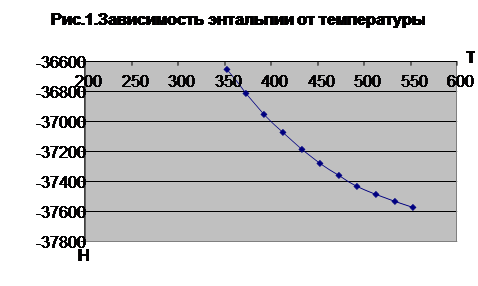
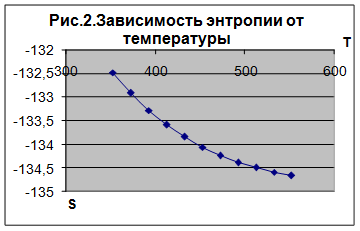
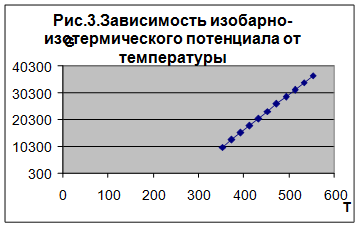

Вывод:
Таким образом в ходе проведенных термодинамических расчетов установили, что данная химическая реакция в данном интервале температур (от 353 до 553 К) имеет H<0, следовательно реакция является экзоотермической.
В ходе химической реакции происходит уменьшение энтропии (S<0), следовательно тепловое (хаотичное) движение молекул уменьшается
Изменение изобарно-изотермического потенциала от 353 К до 553 К положительное, следовательно при заданном интервале реакция протекает самопроизвольно. С ростом температуры G увеличиваетсяся, значит реакцию следует проводить при пониженных температурах.
5
. Расчет
константы равновесия и равновесного состава реагирующих веществ
Все обратимые химические реакции во времени стремятся к равновесию, при котором скорости прямого и обратного процессов уравновешиваются, в результате чего соотношение компонентов в реакционной массе остается неизменным, пока в системе не изменяются параметры технологического режима (температура, давление, концентрации компонентов). При изменении параметров технологического режима равновесие в системе нарушается и самопроизвольно переходит в новое состояние, которое характеризуется новым соотношением компонентов реакционной массы.
Зная значения константы равновесия, можно легко рассчитать состав реакционной массы обратимых химических реакции и определить максимально возможный (теоретический) выход целевого продукта или равновесную степень превращения.
Равновесный состав реакционной смеси простых обратимых реакции находят путем решения уравнении закона действующих масс.
Для основной реакции и заданных давлении и температуры определить константу равновесия Kp. Рассчитать равновесный состав реакционной массы. При расчете использовать данные материального баланса.
A B C
Дано: : CH2=CH-CH3+H2O =CH3-CH(OH)-CH3
Pобщ=1,7 Мпа
T=185o C = 458К
1. Рассчитываем значение константы равновесия для данной реакции при данной температуре:
∆H463=-36130-29,34 (463-298)+78,41∙10-3 (4632-2982) /2-50,84∙10-6∙
(4633-2983) /3-0,33∙105(1/298-1/463)=-37321,3 Дж/моль
∆S463=-130.86-29.34 ln(463/298)+78.41∙10-3(463-298)-50.84∙10-6 ∙
∙(4632-2982)/2-0.33∙105 (1/2982-1/4632) /2=-134.151 Дж/моль∙к
ΔG463=-37321,3+463∙134.151=24790,613 Дж/моль
Kp473=exp(-24790,613/8,314ּ463)=0.0016
2. Запишем выражение для константы равновесия для заданной реакции:
Kp = PC
PB PA
Kp= KNּPобщ∆ν
Kp = NC ּP-1
NB NA
3. Составим баланс молей состояния равновесия:
Таблица Баланс молей
|
nA |
nB |
nC | |
|
исх. смесь |
17.92 |
0.53 |
- |
|
образовалось |
- |
- |
X |
|
израсходовалось |
X |
X |
- |
|
сост. равновесия |
17.92-X |
0.53-X |
X |
∑ni=17.92-X+0.53-X+X=18.45-X
NA= 17.92-X
18.45-X
NB= 0.53- X
18.45-X
NC= X
18.45-X
4.Подставим значения мольных долей в уравнение для константы равновесия:
![]()
―――――――――――=0.0016
![]() *P
*P
2721X2-50202.45X+25840=0
1.36X2-25.1X+12.92=0
Решая квадратное уравнение получаем два корня :
X1=17.926
X2=0.5294
Выбираем корень X2=0.5294
nA=14,1-5,722ּ10-4=14,099428 моль
nB=5,722ּ10-4
nC=22,888ּ10-4
NA=![]()
NB=![]()
Информация о химии
La — Лантан
ЛАНТАН (лат. Lanthanum), La, химический элемент III группы периодической системы, атомный номер 57, атомная масса 138,9055, относится к редкоземельным элементам. Свойства: металл. Плотность 6,162 г/см3, tпл 920 °С. Название: ...
W — Вольфрам
ВОЛЬФРАМ (лат. Wolframium), W, химический элемент VI группы периодической системы, атомный номер 74, атомная масса 183,85. Свойства: светло-серый металл, наиболее тугоплавкий из металлов, плотность 19,3 г/см3, tпл 3380 °С. На ...
Ru — Рутений
РУТЕНИЙ (лат. Ruthenium), Ru, химический элемент VIII группы периодической системы Менделеева, атомный номер 44, атомная масса 101,07, относится к платиновым металлам. Свойства: плотность 12,37 г/см3, tпл 2250 °С, tкип около ...


