Химические реакции аминокислот
Рефераты по химии / Белки и нуклеиновые кислоты / Химические
реакции аминокислотСтраница 1
Аминокислоты могут участвовать во многих реакциях с участием a-амино, a-карбокси и различных функциональных R-групп. Эти реакции подробно рассмотрены в методическом указании «Химия и биохимия аминокислот и полипептидов». Отметим лишь некоторые реакции, имеющие особо важное значение.
Реакция с нингидрином (рН>5) лежит в основе обнаружения и количественного определения аминокислот и белков.
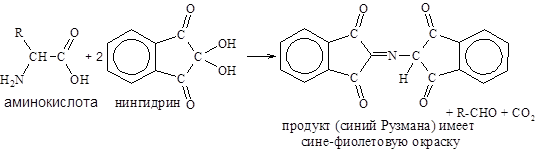
Интенсивность образующейся окраски, оценивают, измеряя поглощение света при длине волны 540 нм (для пролина – 440 нм).
Для идентификации аминокислот служит также получение: 1) фенилтиогитантионовых (ФТТ) производных аминокислот, поглощающих в УФ области; 2) дансильных флуоресцирующих производных (ДНФ) и т.д.
Для пищевиков представляет интерес реакция аминокислот с соединениями, содержащими карбонильную группу С=О, с различными альдегидами и восстанавливающими сахарами (глюкозой, рибозой и отчасти фруктозой). В результате этой реакции происходит разложение как исходной аминокислоты, так и реагирующего с ней восстанавливающего сахара.
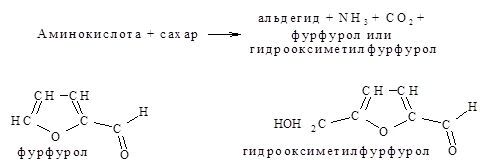
Альдегиды, образовавшиеся из аминокислот, обладают определенным запахом, от которого в значительной степени зависит аромат многих пищевых продуктов.
Лейцин дает запах ржаного хлеба, глицин – карамели, фурфурол – запах зеленого яблока, гидроксиметилфурфурол – запах меда.
Далее фурфурол и гидроксиметилфурфурол реагируют с новой молекулой аминокислоты в результате образуются темноокрашенные соединения – меланоидины. Образование их объясняет наблюдаемое потемнение многих пищевых продуктов во время их изготовления. Особенно интенсивно реакция между аминокислотами и восстанавливающими сахарами происходит при повышенной температуре, имеющей место во время сушки пищевых продуктов, овощей, фруктов, молока, солода. Образование золотисто-коричневой корочки, специфического аромата и вкуса хлеба зависят в основном от меланоидиновых реакций, происходящих при выпечке.
Пептиды
Аминокислоты соединяются друг с другом ковалентной пептидной связью. Образование ее происходит за счет a-аминогруппы (–NH2) одной аминокислоты и a-карбоксильной (–СООН) группы другой с выделением молекулы воды.
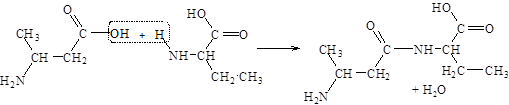
В результате реакции поликонденсации можно получить соединения, составленные из многих аминокислотных остатков – полипептиды. При написании формулы линейных пептидов с известной последовательностью аминокислотных остатков начинают с N-конца (на конце пептида находится свободная a-аминогруппа), используя сокращенные обозначения аминокислот. Названия пептидов складываются из названий соответствующих аминокислот с суффиксом –ил, начиная с N-концевого остатка, – название С-концевой аминокислоты (содержит свободную a-карбоксильную группу) сохраняется. Например, аргинил-аланил-глицин-глутамил-лизин.
Каждый пептид содержит только одну свободную a-амино- и a-карбоксильную группу, которые находятся на концевых остатках аминокислот. Эти группы и R-группы некоторых аминокислот могут быть ионизированы, поэтому пептиды могут нести заряды, и могут быть электронейтральными (т.е. иметь изоэлектрическую точку (ИЭТ). Это свойство пептидов используется для их разделения методами ионной хроматографии и электрофореза. Как и другие соединения, пептиды могут вступать в химические реакции, определяемые наличием у них групп -NH2, -COOH, и R групп-аминокислот. Одной из важных реакций для пептидов является реакция гидролиза. Реакция гидролиза всех пептидных связей путем кипячения растворов пептидов в присутствии сильной кислоты или щелочи используется при определении их аминокислотного состава и состава белков.
Гидролиз пептидных связей может быть осуществлен также действием некоторых ферментов, которые расщепляют пептидные связи избирательно, с образованием коротких пептидов. Например трипсин гидролизует связи образованные карбоксильными группами лизина, аргинина; химотрипсин-карбоксильными группами фенилаланина, тирозина, триптофана. Такой избирательный анализ оказывается очень полезным при установлении аминокислотной последовательности белков и пептидов.
Информация о химии
Крукс (Crookes), Уильям
Английский физик и химик Уильям Крукс родился в Лондоне 17 июня 1832 г. В 1848 –1850 гг. учился в Лондонском химическом колледже, после чего с 1850 по 1854 г. работал в колледже в качестве ассистента А.В.Гофмана. После непр ...
Ge — Германий
ГЕРМАНИЙ (лат. Germanium), Ge, химический элемент IV группы периодической системы, атомный номер 32, атомная масса 72,59. Свойства: серебристо-серые кристаллы; плотность 5,33 г/см3, tпл 938,3 °С. Название: назван от латинско ...
Рёнтген (Rontgen), Вильгельм Конрад
Немецкий физик Вильгельм Конрад Рёнтген родился в Леннепе, небольшом городке близ Ремшейда в Пруссии, и был единственным ребенком в семье преуспевающего торговца текстильными товарами Фридриха Конрада Рентгена и Шарлотты Констанцы ...


