Исследование условий возникновения колебательного режима в процессе окислительного карбонилирования фенилацетилена
Рефераты по химии / Исследование условий возникновения колебательного режима в процессе окислительного карбонилирования фенилацетиленаСтраница 5
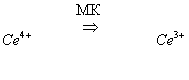
Продукты восстановления бромата, образующиеся на стадии 1, бромируют МК. Получающиеся бромопроизводные МК разрушаются с выделение Br-.
Когда реакция происходит в хорошо перемешиваемой среде, в некоторой области начальных концентраций наблюдаются колебания концентраций, которые имеют период порядка минуты и продолжаются около часа. Например, при взаимодействии Ce4+ с малоновой кислотой в присутствии бромат-иона раствор периодически окрашивается то в вишнево-красный цвет, то становится бесцветным. Такие химические часы будут тикать до тех пор, пока в системе есть бромат и малоновая кислота. Временная периодичность может быть переведена и в пространственную. Капля реактива, нанесенная на подложку из желатина или агар-агара, за счет диффузии рисует великолепные кольца, а две капли создают настоящую интерференционную картину. Постепенно колебания затухают, поскольку система замкнута и в нее не поступают исходные вещества, необходимые для протекания реакции. Если реакцию проводить в длинной трубке, в ней можно наблюдать возникновение горизонтальных зон, соответствующих чередующимся областям высоких концентраций. Наконец, если реакция протекает в тонком перемешиваемом слое, например, в чашке Петри, можно наблюдать различные типы волновой активности- это и концентрационные волны с цилиндрической симметрией, и вращающиеся спиральные волны.
2.1.3. Реакции Брея – Либавского и Бриггса-Раушера
Определенный интерес представляют гомогенные колебательные химические реакции с участием пероксида водорода - реакции Брея - Либавского и Бриггса - Раушера, основанные на проявлении двойственной роли H2O2 как окислителя и восстановителя.
В 1931 году Брей и Либавский и их сотрудники начали серию исследований по реакциям соединений иода с H2O2 [13]. Разложение пероксида водорода, катализируемое иодатом, включает в себя два процесса:
-окисление иода до иодноватой кислоты пероксидом водорода
5H2О2 + I2 = 2HIO3 + 4H2O
-восстановление иодноватой кислоты до иода пероксидом водорода
5H2O2 + 2HIO3 = I2 + 5O2 + 6H2О
Хотя эти реакции были впервые описаны Оже [13], только Брею в 1921 году удалось обнаружить в данной системе колебания, имеющие в условиях эксперимента затухающий характер. Реакция окисления иода до иодноватой кислоты пероксидом водорода - автокаталитическая и протекает с высокой скоростью; скорость реакции восстановления иодноватой кислоты до иода пероксидом водорода относительно невелика.
Система Брея - Либавского является первым известным гомогенным осциллятором и содержит мало компонентов.
Эти колебательные явления почти не привлекали внимания в течение последующих 15 лет. В 1951 году Перд и Каллис [13] подтвердили колебательное выделение О2 и измерили влияние каждого компонента на ее суммарную скорость. Они приписали колебания “очень необычному сочетанию химических и физических факторов”, включая улетучивание иода.
Шоу и Притчард [13] также наблюдали эти колебания, но утверждали, что для колебаний необходим свет, и оспаривали возможность существования гомогенных колебательных систем. Почти полвека продолжались попытки опровергнуть открытые Бреем периодические изменения в процессе взаимодействия иодат-пероксид водорода. Однако в 1967 году было подтверждено наличие колебаний в этой реакции и предложена математическая модель, описывающая колебания, подобные экспериментально наблюдаемым.
В конце 60-х годов Дегн, а также Дегн и Хиггинс [13] показали, что свет не является необходимым для возникновения колебаний; они также использовали Na2O2 и перегнанный H2O2 чтобы исключить влияние ингибиторов. Дегн считал, что, поскольку окисление I2 сильно подвержено влиянию галогенидов и ненасыщенных органических соединений, реакция, возможно идет по свободнорадикальному цепному механизму. На реакцию эти реагенты не влияли. Он отмечал также, что H2O2 ингибирует реакцию. Линдбладу и Дегну [13] удалось смоделировать колебательное поведение, используя гипотетическую схему реакций, включающую квадратичное размножение свободных радикалов. Однако ничего не было сказано по поводу химической природы переменных этой модели.
Информация о химии
Карно (Carnot), Никола Леонар Сади
Французский физик и военный инженер Никола Леонар Сади Карно, один из основателей термодинамики, родился в Париже в семье видного государственного деятеля наполеоновской эпохи Лазара Карно. Его отец, будучи генералом и политиком, ...
Nd — Неодим
НЕОДИМ (лат. Neodymium), Nd, химический элемент III группы периодической системы, атомный номер 60, атомная масса 144,24, относится к лантаноидам. Свойства: плотность 6,908 г/см3, tпл 1016 °С. Металл. Название: от греческого ...
Клаузиус (Clausius), Рудольф Юлиус Иммануил
Немецкий физик Рудольф Юлиус Иммануил Клаузиус родился в Кёслине, Померания. Учился в Берлинском университете (с 1840). По окончании университетского курса в Берлине он был преподавателем в Артиллерийской школе. В 1850–1857 ...


