Мир солей
Рефераты по химии / Мир солейСтраница 4
Графическое изображение формул солей
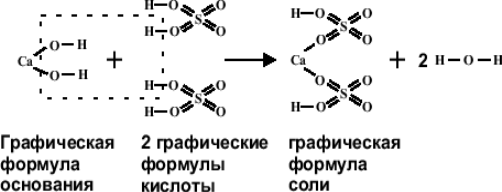
Для того чтобы изобразить формулу соли графически, следует:
- Правильно написать эмпирическую формулу этого соединения.
- Учитывая, что любая соль может быть представлена как продукт нейтрализации соответствующей кислоты и основания, следует написать формулы кислоты и основания, образовавших данную соль. Например, гидросульфат кальция С
a(
HSO4)2
можно получить при нейтрализации серной кислоты H2
SO4
гидроксидом кальция Ca(
OH)2
.
- Определить, какое количество молекул кислоты и основания требуется для получения молекулы этой соли. Например, для получения молекулы Ca(
HSO4)2
требуется одна молекула основания (один атом кальция) и две молекулы кислоты (два кислотных остатка HSO4
).
- Построить графические формулы установленного числа молекул основания и кислоты и, мысленно убрав участвующие в реакции нейтрализации и образующие воду анионы гидроксила основания и катионы водорода кислоты, получить графическое изображение формулы соли:
Классификация солей
Любую соль можно представить как продукт взаимодействия основания и кислоты, то есть как продукт замещения атомов водорода в молекуле кислоты на атом металла или гидроксильных групп в молекуле основания на соответствующие кислотные остатки. В зависимости от состава различают следующие типы солей: средние, кислые, основные, двойные и комплексные.
1. Кислые соли
Кислые соли
- представляют собой продукты неполного замещения атомов водорода атомами металла. Кислые соли - продукт неполной нейтрализации многоосновных кислот основаниями.
От двухосновных кислот (H
2
SO
4
, H
2
CO
3
, H
2
S
и т.д.) производится только один тип кислых солей - однозамещенные (атом металла замещает только один атом водорода кислоты).
Например:
H
2
SO
4
при неполной нейтрализации едким натром образует только одну кислую соль - NaHSO
4
.
От трехосновных кислот можно получить уже два типа кислых солей: однозамещенные и двухзамещенные.
Например:
при нейтрализации H
3
PO
4
едким натром можно получить однозамещенную соль NaH
2
PO
4
:
H3PO4 + NaOH = NaH2PO4 + H2O
и двухзамещенную соль
Na2
HPO4
:
H3PO4 + 2NaOH = Na2HPO4 + 2 H2O
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку "гидро" (от слова hydrogenium – водород). Например:
NaHCO3
– гидрокарбонат натрия,
K2HPO4
– гидрофосфат калия,
KH2PO4
– дигидрофосфат калия.
Диссоциация
:
При диссоциации соли дают катионы металла (NH4+), ионы водорода и анионы кислотного остатка.
NaHCO3 « Na+ + HCO3- « Na+ + H+ + CO32-
2. Средние соли
Средние соли
можно рассматривать, как продукт полного замещения атомов водорода атомами металла:
|
2NaOH |
| H2 SO4 |
|
Na 2 SO 4 |
|
2 H2 O |
|
О снование | кислота | средняя соль |
Информация о химии
Лекок де Буабодран (Lecoq de Boisbaudran), Поль Эмиль
Французский химик Поль Эмиль Лекок де Буабодран родился в г. Коньяк в семье винодела. Образование получил, самостоятельно занимаясь по программе Политехнической школы. С 1854 г. работал в винодельческой фирме своего отца в Коньяке ...
Кюри (Curie), Пьер
Французский физик Пьер Кюри родился в Париже. Он был младшим из двух сыновей врача Эжена Кюри и Софи-Клер (Депулли) Кюри. Отец решил дать своему независимому и рефлексирующему сыну домашнее образование. Мальчик оказался столь прил ...
Nb — Ниобий
НИОБИЙ (лат. Niobium), Nb, химический элемент V группы периодической системы, атомный номер 41, атомная масса 92,9064. Свойства: светло-серый тугоплавкий металл, плотность 8,57 г/см3, tпл 2477 °С, температура перехода в сверх ...


