Теория возмущений в приближении граничных МО
Рефераты по химии / Квантово-химические правила отбора элементарных стадий / Теория возмущений в приближении граничных МОСтраница 1
Из правила БЭП следует, что знание энергетического состояния исходных
и конечных
продуктов позволяет оценивать кинетические характеристики ЭС (вероятность реализации элементарного акта). Метод возмущения МО (МВМО), оперируя только граничными занятыми и свободными МО (ВЗМО, НСМО) и зарядами (на атомах в молекулах и на атомных орбиталях в МО) в исходных
реагентах, позволяет в ряде случаев предсказать вероятность, направление и эффективностьвзаимодействия двух реагентов.
Чем эффективнее взаимодействие, тем ниже Еакт и тем выше вероятность согласованного (элементарного) акта.
Если энергии граничных орбиталей c1 и c2 близки, то энергия взаимодействия определяется резонансным (обменным) интегралом b12
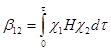 (28)
(28)
где H – гамильтониан системы, t – элемент объема, в котором происходит перекрывание орбиталей. Величина b12 в этом случае определяет и величину расщепления новых МО Y1 и Y2 или энергию стабилизации e = b12.
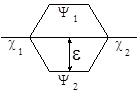
Если энергии c1 и c2 различаются сильно, то величина e определяется не только b12, а зависит и от разности энергий c1 и c2 по уравнению (29):
![]() (29)
(29)
где Е1 и Е2 – энергии низшей и высшей МО
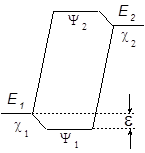
Чем больше величина e , тем стабильнее образующийся аддукт, тем ниже Еакт его образования.
МВМО не дает оценки Е переходного состояния и Еакт. Рассчитывается лишь разница между полной электронной энергией реагирующей системы Е и энергиями исходных реагентов ![]() и
и ![]() (малое возмущение):
(малое возмущение):
![]() DЕ = Е –
DЕ = Е – ![]() –
– ![]() , (30)
, (30)
справедливое только для начальных участков координаты реакции. Только на больших расстояниях между реагентами не происходит смешения МО, нет межмолекулярного отталкивания и можно говорить о чистых МО исходных реагентов. Вместе с тем, такое приближение позволяет оценить наиболее вероятный путь реакции.
Энергию возмущения DЕ при взаимодействии реагентов S и Т (S и Т – молекулы или активные центры в молекулах) рассчитывают по уравнению (31):
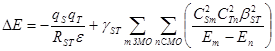 (31)
(31)
В случае только двух граничных МО (например, молекул донора и акцептора) уравнение упрощается (32):
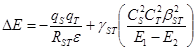 (32)
(32)
В уравнениях (31, 32) qS и qT – эффективные заряды на центрах S и Т, RST – расстояние между центрами в ходе взаимодействия, e – диэлектрическая проницаемость среды. Таким образом, первый член (возмущение 1го порядка) отражает энергию кулоновского взаимодействия. Второй член (возмущение 2го порядка) определяет энергию орбитального перекрывания и включает: gST – коэффициент, учитывающий заселенность электронами орбиталей c1 и c2, ![]() и
и ![]() – квадраты коэффициентов при атомных орбиталях центров S и Т волновой функции граничных МО c1 и c2,
– квадраты коэффициентов при атомных орбиталях центров S и Т волновой функции граничных МО c1 и c2, ![]() – квадрат обменного интеграла, Е1 и Е2 – энергии орбиталей c1 и c2. Разные случаи заселенности орбиталей c1 и c2 реагирующих частиц и коэффициент gST приведены ниже:
– квадрат обменного интеграла, Е1 и Е2 – энергии орбиталей c1 и c2. Разные случаи заселенности орбиталей c1 и c2 реагирующих частиц и коэффициент gST приведены ниже:
|
Число электронов на граничных орбиталях |
gST |
|
2 + 2, 0 + 0 |
0 (нет перекрывания) |
|
2 + 1, 1 + 0 |
1 |
|
2 + 0, 1 + 1 |
2 (самое сильное перекрывание) |
Информация о химии
Праут (Prout), Уильям
Английский врач и химик Уильям Праут родился в Хортоне (Глостершир). В 1811 г. он окончил Эдинбургский университет, получив степень доктора медицины. Будучи практикующим врачом в Лондоне, самостоятельно занимался исследованиями в ...
Синг (Synge), Ричард Лоренс Миллингтон
Английский биохимик Ричард Лоренс Миллингтон Синг родился в Ливерпуле. Он был старшим ребенком и единственным сыном Кэтрин Шарлотты (Суонн) и Лоренса Миллингтона Синга, биржевого маклера. Занимаясь в Винчестер-колледже, подготовит ...
Хиншелвуд (Hinshelwood), Сирил Норман
Английский химик Сирил Норман Хиншелвуд родился в Лондоне и был единственным ребенком у Этель (в девичестве Смит) и Нормана Хиншелвуд. Его отец, бухгалтер, перевез семью в Канаду по соображениям бизнеса, а также из-за слабого здор ...


