Квантово-механическая модель атома. Квантовые числа. Атомные орбитали. Порядок заполнения орбиталей электронами
Рефераты по химии / Общая и неорганическая химия / Квантово-механическая модель атома. Квантовые числа. Атомные орбитали.
Порядок заполнения орбиталей электронамиСтраница 3
Состояние электрона характеризующееся различными значениями главного квантового числа ![]() , называется электронным слоем (электронной оболочкой, энергетическим уровнем). Они обозначаются цифрами 1, 2, 3, 4, 5, … или соответственно буквами K, L, M, N, O ….
, называется электронным слоем (электронной оболочкой, энергетическим уровнем). Они обозначаются цифрами 1, 2, 3, 4, 5, … или соответственно буквами K, L, M, N, O ….
Квантовое состояние атома с наименьшей энергией – основное состояние, а с более высокой – возбуждённое состояние. Переход электрона с одного уровня на другой сопровождается либо поглощением, либо выделением энергии: ![]() .
.
Побочное квантовое (орбитальное, азимутальное) число ![]() (принимает все целочисленные значения от 0 до (n-1)).
(принимает все целочисленные значения от 0 до (n-1)).
|
|
|
Орбиталь |
|
1 |
0 |
1s |
|
2 |
0,1 |
2s,2p |
|
3 |
0,1,2 |
3s,3p,3d |
Состояние электрона характеризующееся различными значениями побочного квантового числа ![]() называется энергетическим подуровнем. В пределах каждого уровня с увеличением
называется энергетическим подуровнем. В пределах каждого уровня с увеличением ![]() , растёт энергия орбитали.
, растёт энергия орбитали.
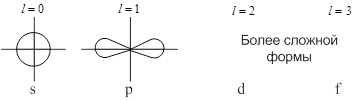
Каждому значению ![]() соответствует определённая форма орбитали (например, при
соответствует определённая форма орбитали (например, при ![]() – это сфера, центр которой совпадает с ядром).
– это сфера, центр которой совпадает с ядром).
Магнитное квантовое число ![]() характеризует ориентацию орбитали в пространстве (принимает все целочисленные значения от -
характеризует ориентацию орбитали в пространстве (принимает все целочисленные значения от - ![]() до +
до +![]() ).
).
Например, для ![]()
![]() . В пределах каждого подуровня орбиталь имеет одинаковую энергию.
. В пределах каждого подуровня орбиталь имеет одинаковую энергию.
Спиновое квантовое число ![]() характеризует вращательный момент, который приобретает электрон в результате собственного вращения вокруг своей оси (принимает два значения:
характеризует вращательный момент, который приобретает электрон в результате собственного вращения вокруг своей оси (принимает два значения: ![]() – вращение по часовой стрелке,
– вращение по часовой стрелке, ![]() – вращение против часовой стрелки).
– вращение против часовой стрелки).
Атомные орбитали заполняются электронами в соответствии с 3-мя принципами:
Информация о химии
Ломоносов, Михаил Васильевич
Русский учёный Михаил Васильевич Ломоносов родился в селе Денисовка Архангельской губернии (ныне с. Ломоносово) в семье помора. В 1731 г. он поступает учиться в Славяно-греко-латинскую академию в Москве, выдав себя за дворянского ...
Uut — Ununtrium (Унунтриум)
УНУНТРИУМ (Унунтритий, ?Унунтрий?) (лат. Ununtrium), Uut, химический элемент III группы периодической системы, атомный номер 113, атомная масса [284], наиболее устойчивый изотоп 284Uut. Свойства: Радиоактивен. Металл, повидимому ...
Зигмонди (Zsigmondy), Рихард Адольф
Немецкий химик Рихард Адольф Зигмонди (Жигмонди) родился в Австрии, в Вене, в семье Ирмы (фон Закмари) и Адольфа Зигмонди, у которых было четверо детей. Его отец, преуспевающий врач, опубликовавший несколько работ по медицине, поо ...


