Введение
Рефераты по химии / Синтез нитробензойной кислоты / ВведениеСтраница 1
Ароматическими карбоновыми кислотами называются производные бензола, содержащие карбоксильные группы, непосредственно связанные с углеродными атомами бензольного ядра. Кислоты, содержащие карбоксильные группы в боковой цепи, рассматриваются как жирноароматические.
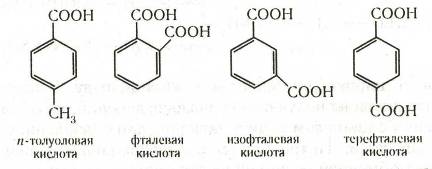
Ароматические кислоты могут быть разделены по количеству карбоксильных групп на одно-, двух- и более основные. Названия кислот, у которых карбоксильная группа непосредственно связана с ядром, производятся от ароматических углеводородов. Названия кислот с карбоксилом в боковой цепи производятся обычно от наименований соответствующих кислот жирного ряда. Наибольшее значение имеют кислоты первого типа: например, бензойная (бензолкарбоновая) С6Н5—СООН, п-толуиловая
(п-толуолкарбоновая), фталевая (1,2-бензолдикарбоновая), изофталевая (1,3-бензолдикарбоновая), терефталевая (1,4-бензолдикарбоновая):
Из кислот второго типа отметим фенилуксусную кислоту (I), метилфенилуксусную,
или 2-фенилпропановую, кислоту (
II):
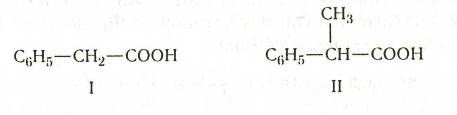
Физические свойства
Монокарбоновые кислоты ряда бензола — бесцветные кристаллические вещества с температурой плавления выше 100 °С. Кислоты с пара-положением заместителей плавятся при значительно более высоких температурах, чем их изомеры. Ароматические кислоты кипят при несколько более высоких и плавятся при значительно более высоких температурах, чем кислоты жирного ряда с тем же числом углеродных атомов. Монокарбоновые кислоты довольно плохо растворяются в холодной воде и значительно лучше в горячей. Низшие кислоты летучи с парами воды.
В водных растворах монокарбоновые кислоты обнаруживают большую степень диссоциации, чем кислоты жирного ряда: константа диссоциации бензойной кислоты 6,6·10-5 , уксусной кислоты 1,8·10-5.
Отдельные представители. Применение
Бензол был открыт Фарадеем в 1825 г. и была установлена его брутто-формула-С6Н6. В 1865 г. Кекуле предложил его структурную формулу как циклогексатриена-1,3,5. Этой формулой пользуются и в настоящее время, хотя она, как позднее будет показано, несовершенна - не отвечает полностью свойствам бензола.
Наиболее характерной особенностью химического поведения бензола является удивительная инертность двойных углерод-углеродных связей в его молекуле: в отличие от рассмотренных; ранее непредельных соединений он устойчив к действию окислителей (например, перманганата калия в кислой и щелочной среде, хромового ангидрида в уксусной кислоте) и не вступает в обычные реакции электрофильного присоединения, характерные для алкенов, алкадиенов и алкинов.
Пытаясь объяснить свойства бензола особенностями строения, многие ученые вслед за Кекуле выдвигали по этому поводу свои гипотезы. Поскольку непредельность бензола явно не проявлялась, считали, что двойных связей в молекуле бензола нет. Так, Армстронг и Байер, а также Клаус предположили, что в молекуле бензола четвертые валентности всех шести атомов углерода направлены к центру и насыщают друг друга, Ладенбург - что углеродный скелет бензола представляет собой призму, Чичибабин - что в бензоле углерод трехвалентен.
Тиле, усовершенствуя формулу Кекуле, утверждал, что двойные связи в последнем не фиксированы, а постоянно перемещаются-«осциллируют», а Дьюар и Хюккель предложили структурные формулы бензола с двойными связями и малыми циклами.
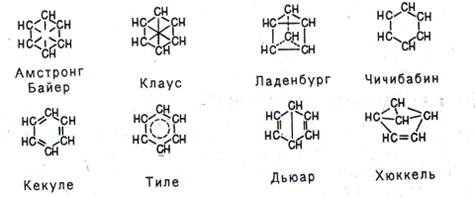
В настоящее время на основании данных многочисленных исследований можно считать твердо установленным, что шесть углеродных и шесть водородных атомов в молекуле бензола находятся в одной плоскости и что облака π-электронов атомов углерода перпендикулярны плоскости молекулы и, следовательно, параллельны друг другу и взаимодействуют между собой. Облако каждого π-электрона перекрывается облаками π-электронов соседних углеродных атомов. Реальная молекула бензола с равномерным распределением π-электронной плотности по всему кольцу может быть представлена в виде плоского шестиугольника, лежащего между двумя торами.
Информация о химии
Ag — Серебро
СЕРЕБРО (лат. Argentum), Ag, химический элемент I группы периодической системы Менделеева, атомный номер 47, атомная масса 107,8682. Свойства: металл белого цвета, ковкий, пластичный; плотность 10,5 г/см3, tпл 961,9 °С. Один ...
Токсикологическая химия
Токсикологическая химия - наука, изучающая методы выделения токсических веществ из различных объектов, а также методы обнаружения и количественного определения этих веществ. Эта наука, которая разрабатывает новые и совершенствует ...
Гитон де Морво (Guyton de Morveau), Луи Бернар
Французский химик и политический деятель Луи Бернар Гитон де Морво родился в городе Дижоне, Бургундия. Получил блестящее юридическое образование; уже в восемнадцатилетнем возрасте занял место генерального адвоката при дижонском па ...


