Исследование твердых электролитов
Рефераты по химии / Исследование твердых электролитовСтраница 24
С середины 70-х годов ортофосфат лития известен как ионный проводник, в структуре которого пустоты кристаллического каркаса формируют сквозные прямые каналы вдоль осей а и с и зигзагообразные вдоль оси b (рис.3). Однако величина электропроводности не очень высока, поскольку, несмотря на "рыхлость" структуры, все катионы лития участвуют в постройке жесткого каркаса и не способны свободно перемещаться по каналам. Решение задачи увеличения ионной проводимости напрашивается само собой: необходимо поместить в каналы дополнительные катионы Li. Это достигается специальным введением в базовый материал гетеровалентных примесей, что и наблюдается в твердых растворах со структурой высокотемпературной модификации Li3PO4.
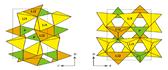
Рис.3. Каналы проводимости в структуре Li3PO4 образуются при формировании каркаса из связанных общими вершинами тетраэдров [Li1O4], [Li2O4] и [PO4]. а - проекция bc, б - проекция аb.
Получаемые нестехиометрические фазы систем Li4GeO4-Li3VO4 и Li4GeO4-Li3PO4 обладают ионной проводимостью, значения которой составляют 10–4-10–5 Ом–1·см–1 уже при комнатной температуре. Чтобы понять механизм ионного транспорта, потребовалось провести экспериментальные исследования на монокристаллах больших размеров и хорошего качества. Монокристаллы Li3+xP1–xGexO4 (x=0.34) были выращены в Институте кристаллографии методом кристаллизации из раствора в расплаве. Величины удельной проводимости кристалла Li3.34P0.66Ge0.34O4 составляют 1.8·10–6 и 3.7·10–2 Ом–1·см–1 при 40° и 400°С соответственно - что, как видно из рис.4, на несколько порядков выше проводимости номинально чистого -Li3PO4.

Рис.4. Ионная проводимость монокристаллов Li3PO4 и Li3+xP1–xGexO4. Разными значками изображены величины проводимости в различных кристаллографических направлениях.
Миграция ионов лития в твердом растворе Li3+xP1–xGexO4 связана с внедрением дополнительных катионов Li+ в пустоты кристаллического каркаса, что приводит к разупорядочению литиевой подрешетки не только в каналах проводимости, но и в жестком каркасе (рис.5), и число доступных для миграции лития позиций существенно возрастает. Кристаллическая структура при этом становится приблизительно одинаково "прозрачной" для ионного транспорта во всех направлениях, благодаря чему значения проводимости по трем главным кристаллографическим направлениям почти выравниваются (анизотропия проводимости в твердом растворе Li3+xP1–xGexO4 по сравнению с Li3PO4 понижается).
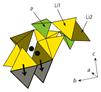
Рис.5. Фрагмент кристаллической структуры твердого раствора Li3+xP1–xGexO4. Зеленым цветом показаны тетраэдры PO4, желтым и коричневым - тетраэдры LiO4. Дополнительные ионы лития (темные кружки) при образовании твердого раствора смещаются в направлении, показанном стрелками. Собственные ионы лития переходят в тетраэдры, ребра которых выделены жирными линиями (в чистом -Li3PO4 эти тетраэдры незаняты).
Литий-замещенный титанат лантана Li0.255La0.582TiO3 может служить еще одним примером целенаправленного конструирования твердого электролита. Внедрение достаточно большого количества посторонних атомов, в том числе и лития, в кристаллическую матрицу перовскито-подобной фазы La2/3TiO3 приводит к образованию нестехиометрических фаз La2/3–xLi3x}1/3–2xTiO3. Ионный перенос осуществляется за счет перескока внедренных ионов лития по вакантным позициям. Создание монокристаллов таких сложных фаз сродни искусству, и это в полной мере относится к синтезу литий-замещенного титаната лантана методом бестигельной зонной плавки (блок-схема установки показана на рис.6). В полученных кристаллах высокая ионная проводимость при комнатной температуре (около 5·10–4 Ом–1·см–1) соседствует с пренебрежимо малой величиной электронной проводимости.
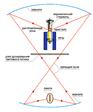
Рис.6. Схема установки для выращивания кристаллов методом бестигельной зонной плавки.
Чтобы вырастить монокристаллы, керамический стержень плавят направленным световым пучком мощной лампы. При опускании стержня в печь, имеющую температурный градиент, происходит кристаллизация расплава с формированием массивного монокристалла. Позвольте пройти, или "Окно проводимости". На первый взгляд кристаллическая структура Li0.255La0.582TiO3 не должна допускать высокой ионной проводимости, поскольку размеры "окна проводимости" (рис.7) недостаточны для беспрепятственного перемещения ионов Li+ по каналам. Наблюдаемое противоречие можно объяснить особой ролью тепловых колебаний атомов кристаллического каркаса, из-за которых размер "окна проводимости" постоянно меняется - каналы "дышат". Перескок ионов в соседнюю позицию может происходить в момент наибольшей открытости "окна".
Информация о химии
Коперник (Kopernik, Copernicus), Николай
Польский астроном, создатель гелиоцентрической системы мира Николай Коперник родился в Торуни в семье купца. После смерти отца (1483) воспитывался своим дядей Лукашем Ваченроде, епископом Вармийской епархии (Вармия – исконна ...
Требования стандарта к изучению темы "Окислительно-восстановительные реакции"
Опираясь на новый образовательный стандарт по химии за 2004 год [16] , можно выделить обязательный минимум содержания знаний и умений в курсе химии: · стандарт основ ...
Er — Эрбий
ЭРБИЙ (лат. Erbium), Er, химический элемент III группы Периодической системы, атомный номер 68, атомная масса 167,26, относится к лантаноидам. Свойства: металл. Плотность 9,045 г/см3, tпл 1522 °С. Компонент магнитных сплавов ...


