Исследование фазовых эффектов в бинарных азеотропных смесях
Рефераты по химии / Исследование фазовых эффектов в бинарных азеотропных смесяхСтраница 9
![]() 2.2
2.2
В обоих случаях векторы колинеарны, т.е. лежат на одной прямой, а их направления определяются знаком dt, как скалярного множителя (бесконечно малого).
Возвращаясь к диаграмме (рис.2.1), в случае постоянной температуры и переменного давления, вектор ![]() лежит на одной прямой с вектором, который имеет координаты
лежит на одной прямой с вектором, который имеет координаты ![]() , что и показано на рисунке. Если же рассматривается этот же состав х1, имеющий объем Vж, то при постоянных давлении и температуры, направление вектора
, что и показано на рисунке. Если же рассматривается этот же состав х1, имеющий объем Vж, то при постоянных давлении и температуры, направление вектора ![]() должно совпадать с направлением изотермо-изобары жидкой фазы. Следовательно, этот вектор не колинеарен вектору
должно совпадать с направлением изотермо-изобары жидкой фазы. Следовательно, этот вектор не колинеарен вектору ![]() . Образно говоря, движущая сила этого смещения состава, другая. Эта движущая сила должна лежать на касательной к изотермо-изобаре жидкости, т.е. проекция на ось абсцисс х, у остается при этом неизменной, а изменяется проекция на ось ординат V. Таким образом, векторы
. Образно говоря, движущая сила этого смещения состава, другая. Эта движущая сила должна лежать на касательной к изотермо-изобаре жидкости, т.е. проекция на ось абсцисс х, у остается при этом неизменной, а изменяется проекция на ось ординат V. Таким образом, векторы ![]() и
и ![]() имеют разное направление, т.е. смещены друг относительно друга на угол β.
имеют разное направление, т.е. смещены друг относительно друга на угол β.
Таким образом, величина, определяющая вектор![]() находится по определенной методике:
находится по определенной методике:
1. Проводим касательную к изотермо-изобаре жидкости в точке с координатами х1, Vж.
2. Пересечение этой прямой с прямой у1=const, дает вторую точку вектора (А).
3. Следовательно, вектор равен (см. рис. 2.1)
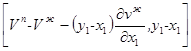
Начальной точкой этого вектора является точка с координатами х1, Vж. Конечной точкой является точка А. В самом деле, если рассматривается коннода жидкость-пар (рис.2.3), то её координаты равны ![]()
Полученные результаты находятся в полном соответствии с физико-химическим смыслом. В самом деле, при dt<0 часть веществ уходит из жидкой фазы при постоянном давлении и температуре, следовательно, объем жидкой фазы уменьшается. При приходе dm молей в жидкую фазу объем жидкой фазы, в общем, увеличивается.
Таим образом, для азеотропных смесей частные фазовые эффекты жидкой фазы противоположны по знаку частным фазовым эффектам паровой фазы. В отличие от общих они не равны нулю в азеотропных точках.
2.2.Вывод уравнений Ван-дер-Ваальса для жидкой и паровой фаз.
Уравнение Ван-дер-Ваальса является представлением разности нулевых потенциалов Гиббса в координатах g-потенциала [14].
Напомним, что для жидкой фазы нулевой потенциал для бинарной смеси обычно записывается в форме [14]
Sж dT –Vж dР+ x1 dμ1 + x2 dμ2=0 2.7
g-потенциал, соответственно, равен
dgж= -Sж dT +Vж dР+ μ1dх1+ μ2 dх2 2.8
Аналогично для паровой фазы имеем
Sп dT –Vп dР+ у1 dμ1 + у2 dμ2=0 2.9
dgп= -Sп dT +Vп dР+ μ1dу1+ μ2 dу2 2.10
В работе [14] дан вывод нулевого потенциала. Приведем его полностью. Для случая бинарной смеси уравнение внутренней энергии имеет вид:
Информация о химии
Гей-Люссак (Gay-Lussac), Жозеф Луи
Французский физик и химик Жозеф Луи Гей-Люссак родился в Сен-Леонар-де-Нобла (департамент Верхняя Вьенна). Получив в детстве строгое католическое воспитание, в 15 лет он переехал в Париж; там, в пансионе Сансье, юноша продемонстр ...
Zr — Цирконий
ЦИРКОНИЙ (лат. Zirconium), Zr, химический элемент IV группы периодической системы Менделеева, атомный номер 40, атомная масса 91,224. Свойства: серебристо-белый металл, твердый, тугоплавкий; плотность 6,50 г/см3, tпл 1855 °С. ...
Брёнстед (Bronsted), Йоханнес Николаус
Датский физикохимик Йоханнес Николаус Брёнстед родился в Варде. В 1897 г. поступил в Копенгагенский университет; в 1899 г. сдал экзамен на звание инженера, в 1902 г. стал магистром, а в 1908 г. – доктором наук. С 1905 г. раб ...


