Сущность и природа водородной связи
Рефераты по химии / Водородная связь / Сущность и природа водородной связиСтраница 1
Первую научную трактовку водородной связи дали в 1920 году В. Латимер и В.Родебуш, работавшие в лаборатории Г. Льюиса, основоположника учения о ковалентной связи, автора теории кислот и оснований и плодотворной в органической химии концепции обобщенной электронной пары. Причину особых физических и химических свойств воды авторы объясняли наличием водородной связи, сущность которой состоит во взаимодействии атома водорода одной молекулы с электронной парой атома кислорода другой молекулы. При этом атом водорода становится одновременно связанным с двумя атомами кислорода ковалентной и водородной связью:
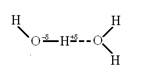
За все последующее время вплоть до наших дней не изменился принципиальный подход к трактовке водородной связи, концепция неподелённого протона осталась незыблемой. Длительные и интенсивные исследования позволили уточнить влияние структуры соединений на склонность к образованию Н-связей, внесена определенная ясность в электронную природу последних, найдены надежные методы их идентификации. А главное - сделаны широкие обобщения по оценке влияния Н-связей на физические и химические свойства веществ. Бутлеровский тезис “структура определяет свойства” раскрывается с учетом возможности образования Н-связи и ее вклада в конкретные свойства. Ниже представлен итоговый материал по изучению вопросов, связанных с проблемой водородной связи.
По современной терминологии, образование водородной связи наступает при взаимодействии протонодонора (кислоты Бренстеда, электроноакцептора) с протоноакцептором (основанием, электронодонором). Для схематичного представления обсуждаемых процессов молекулу протонодонора обозначим А-Н (а для случаев, когда необходимо указать природу атома, ковалентно связанного с водородом, R-X-H). Протоноакцептор обозначим: В (символическое обозначение как основания в целом, так и атома с неподеленной парой электронов) или B-Y. С учетом принятой символики водородную связь можно представить как невалентное взаимодействие между группой Х-Н одной молекулы и атомом В другой, в результате которого образуется устойчивый комплекс А-Н…В с межмолекулярной водородной связью, в котором атом водорода играет роль мостика, соединяющего фрагменты А и В. Отметим, что до настоящего времени нет однозначного подхода, какую конкретно связь называть водородной. Большинство авторов к понятию водородной связи относят дополнительное взаимодействие, которое возникает между атомом водорода и электронодонором В, то есть связь Н…В. Другие авторы к понятию водородной связи относят всю цепочку Х-Н…В, то есть связь между атомами Х и В через водородный мостик. Ориентируясь на большинство, характеристики водородной связи (длина, энергия) будем относить к связи Н…В, сознавая, что образование последней не может не сказаться на состоянии ковалентной связи Х-Н.
На ранних этапах изучения водородной связи полагали, что водородный мостик образуется только между атомами с высокой электроотрицательностью (F, O, N). В последние десятилетия, когда в руках исследователей появилось более совершенное оборудование, круг атомов - партнеров по водородному связыванию значительно расширен (Cl, S и некоторые другие). В качестве атома Х может фигурировать любой атом, более электроотрицательный по сравнению с атомом водорода и образующий с последним обычную химическую связь (например, атом углерода). В роли акцептора атома водорода могут выступать как атомы с неподеленными парами электронов (в отдельных случаях даже аргон и ксенон), так и соединения, имеющие π-связи.
Информация о химии
Альберт Великий (Albertus Magnus)
1193? – 15 ноября 1280 г. Альберт ВеликийВыдающийся немецкий теолог, философ и естествоиспытатель Альберт фон Больштедт (von Bollstadt), сын графа Больштедта, родился в Лауингене близ Аугсбурга в Швабии. При жизни его обычн ...
Гей-Люссак (Gay-Lussac), Жозеф Луи
Французский физик и химик Жозеф Луи Гей-Люссак родился в Сен-Леонар-де-Нобла (департамент Верхняя Вьенна). Получив в детстве строгое католическое воспитание, в 15 лет он переехал в Париж; там, в пансионе Сансье, юноша продемонстр ...
Джилберт (Gilbert), Уолтер
Американский молекулярный биолог Уолтер Джилберт родился в г. Бостон (штат Массачусетс), в семье Рихарда Джилберта, экономиста кейнсианского толка, который с 1924 по 1939 г. преподавал в Гарвардском университете, и Эммы Джилберт ( ...


