Коррозия технических металлов
Рефераты по химии / Теоретические основы электрохимической коррозии / Коррозия технических металловСтраница 1
Все высказанные до сих пор соображения о коррозионном процессе относились к случаю электрохимического растворения идеально чистого металла с совершенно однородной по своим свойствам поверхностью. В реальных условиях коррозии подвергаются чаще всего технические металлы, содержащие примеси других металлов и неметаллических веществ. На их поверхности всегда можно обнаружить включения посторонних металлов. Кроме того, она обычно покрыта продуктами взаимодействия металла с окружающей средой, всевозможными загрязнениями. Естественно, что неоднородность поверхности и, прежде всего, присутствие на ней посторонних металлов с другими электрохимическими свойствами должны влиять на скорость коррозии и на характер ее протекания. Рассмотрим, например, как при этих условиях изменится скорость и характер коррозии цинка. Предположим, что в образцах цинка имеются включения или свинца, или серебра, или железа - обычные примеси в техническом цинке. Как следует из величин стандартных потенциалов, все эти металлы электроположительнее цинка. Поэтому можно предположить, что коррозии подвергается лишь цинк, а металлы-примеси остаются в неизменном виде. При этих допущениях коррозия должна протекать с водородной деполяризацией и ее скорость определяется кинетикой выделения водорода на корродирующем металле. В отличие от идеально чистого цинка, водород в этом случае может разряжаться не только на нем, но и на металле-примеси. Суммарная скорость выделения водорода, а следовательно, и суммарная скорость растворения цинка определяется поэтому кинетикой выделения водорода на основном металле и на включениях постороннего металла.
Таким образом, присутствие в цинке примесей свинца - металла с более высоким перенапряжением водорода - не увеличивает, а несколько снижает скорость коррозии.
Присутствие серебра в цинке должно увеличить скорость его коррозии. При выбранных условиях эта скорость возрастает в три с половиной раза. Однако увеличение скорости растворения не является единственным результатом загрязнения цинка серебром. Меняется и характер коррозии.
Серебро, обладая электроположительным потенциалом, не будет растворяться; на нем возможен лишь катодный процесс - выделение водорода. Цинк в присутствии включений серебра играет роль анода, и на нем сосредоточен весь процесс растворения. Кроме того, цинк выступает и в роли катода, обеспечивая выделение одной четвертой части от общего количества разряжающегося водорода.
Еще большего увеличения скорости коррозии и еще более полного разделения поверхности металла на анодные и катодные участки следует ожидать, когда цинк загрязнен железом. В этом случае анодные и катодные реакции оказываются пространственно разделенными. Анодная реакция целиком сосредоточена на поверхности цинка, а катодная - на поверхности включений железа.
В этих условиях корродирующий технический цинк можно рассматривать как совокупность гальванических микроэлементов, в каждом из которых железо (катод) является положительным полюсом, а анодно растворяющийся цинк - отрицательным. Коррозию такого технического металла можно на этом основании рассматривать как результат действия локальных гальванических элементов.
По теории местных элементов скорость коррозии (или пропорциональный ей электрический ток, возникающий в результате работы локальных гальванических пар) зависит не только от электрохимических свойств электродов этих пар, но и от омического сопротивления той среды, в которой совершается процесс коррозии и которая отделяет анод от катода. Определяющие скорость коррозии соотношения удобнее выразить графически при помощи так называемых коррозионных диаграмм. На коррозионной диаграмме (рисунок 2) потенциалы анода и катода или потенциалы анодного и катодного процессов представлены как функция силы тока.
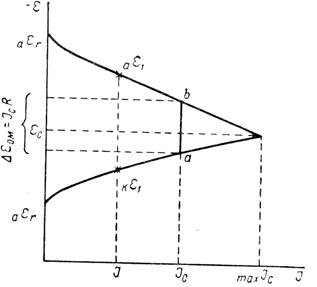
Рисунок 2 - Коррозионная диаграмма
Когда нет коррозионного процесса и сила тока равна нулю, тогда начальные значения потенциалов на аноде и катоде должны отвечать обратимым потенциалам анодной аεr и катодной kεr реакций в заданных условиях. За счет разности потенциалов анода и катода в системе появляется ток. При некоторой силе тока I потенциал анода сместится вследствие поляризации в сторону более положительных, а потенциал катода - в сторону более отрицательных значений. Пусть эти величины будут равны соответственно аε1 и kε1. Разность этих потенциалов под током меньше разности их обратимых потенциалов. С увеличением силы тока разность между потенциалом анода и катода будет непрерывно сокращаться. В пределе она окажется равной нулю, и поверхность корродирующего образца сделается эквипотенциальной. Здесь будет достигнута сила тока, отвечающая максимально возможной в данных условиях скорости коррозии maxIc, а потенциал образца станет равным величине εс , лежащей между аεr и кεr. Это максимальное значение силы тока может быть реализовано лишь тогда, когда сопротивление системы или равно нулю, или ничтожно мало. В противном случае, если омическое падение напряжения не равно нулю, скорость коррозии будет не maxIc , а некоторой меньшей величиной Iс. В этих условиях омическое падение напряжения ∆εOM численно равно длине отрезка ab. Потенциал анода в процессе коррозии будет отрицательнее потенциала катода на величину ∆εOM. Таким образом, скорость коррозии является функцией разности обратимых потенциалов анодной и катодной реакций, их поляризуемости и омического сопротивления коррозионной среды. Влияние каждого из этих факторов на скорость коррозии показано графически на рисунке 3 при помощи упрощенных коррозионных диаграмм. Скорость коррозии уменьшается, если при заданном сопротивлении и неизменной поляризуемости электродов обратимые потенциалы анодной и катодной реакций сближаются (рисунок 3,а), то есть Iс изменяется параллельно с величиной (кεr - аεr). Скорость коррозии становится меньше при увеличении общего сопротивления в системе корродирующий металл - коррозионная среда (рисунок 3,б). Повышение анодной (рисунок 3,в) или катодной (рисунок 3,г) поляризации также уменьшает скорость коррозии. Повышение поляризации может быть результатом появления дополнительных торможений как анодного, так и катодного процессов, либо уменьшением площади анодных или катодных участков. Сокращение площади данного электрода при неизменной силе тока увеличивает на нем плотность тока, а следовательно, и поляризацию.
Информация о химии
Аналитическая химия
Предмет и задачи аналитической химии (АХ). Значение АХ в производственной и научно-исследовательской деятельности человека. Химические и физико-химические методы анализа. Качественный и количественный анализ. ...
O — Кислород
КИСЛОРОД (лат. Oxygenium), O (читается «о»), химический элемент с атомным номером 8, атомная масса 15,9994. В периодической системе элементов Менделеева кислород расположен во втором периоде в группе VIA. Природный ки ...
Зоман
Синонимы: EA 1210 GD soman метилфторфосфоновой кислоты пинаколиловый эфир Внешний вид: бесцветн. жидкость Брутто-формула (система Хилла): C7H16FO2P CAS №: 96-64-0 Молекулярная масса (в а.е.м.): 182,17 Температура плавл ...


