Условия возникновения коррозионного процесса
Рефераты по химии / Теоретические основы электрохимической коррозии / Условия возникновения коррозионного процессаСтраница 2
![]() (4)
(4)
Следовательно, поведение корродирующего электрода отвечает поведению обратимого металлического электрода, а установившееся значение компромиссного потенциала близко к равновесному потенциалу соответствующего металлического электрода и должно изменяться с концентрацией ионов металла в соответствии с формулой Нернста.
Изменение рН раствора не влияет при этом заметно на величину стационарного потенциала. Таким образом, здесь стационарный потенциал коррозии сε приводится к обратимому потенциалу металла Мεr (уравнение 5):
сε ≈ Мεr (5)
В качестве примеров таких систем можно привести разложение амальгам и электрохимическое растворение цинка.
Напротив, если ток обмена водорода значительно больше тока обмена металла, то
![]() ,
,
![]()
и, с некоторым приближением, можно получить уравнение 6:
![]() (6)
(6)
Теперь уже компромиссный потенциал близок к потенциалу водородного электрода в данных условиях. Его величина закономерно изменяется с рН и почти не зависит от концентрации ионов металла. Таким образом, здесь стационарный потенциал приводится к потенциалу водородного электрода (уравнение 7):
сε = Нεr (7)
Коррозия железа в слабокислых растворах служит примером подобного рода систем.
Необходимым условием электрохимической коррозии является совмещение на поверхности корродирующего металла реакций ионизации и разряда его ионов с какой-либо другой электродной реакцией, протекающей преимущественно в катодном направлении.
В водных средах, не содержащих иных окислителей, кроме ионов водорода и растворенного кислорода, это условие выполняется в том случае, если равновесный потенциал металла отрицательнее равновесного потенциала водородного или кислородного электродов в растворе данного состава. Добавление к раствору других окислителей с более положительным равновесным потенциалом увеличивает число металлов, способных корродировать. Так, серебро, стойкое в водных растворах не восстанавливающихся кислот, корродирует при добавлении окислителя с потенциалом более положительным, чем равновесный потенциал серебряного электрода.
4 Основы кинетической теории коррозии и ее приложение к коррозии идеально чистых металлов
Протекание процесса растворения металла указывает на то, что в данных условиях скорость ионизации больше скорости разряда его ионов:
![]()
В отсутствии внешнего тока и при условии сохранения неизменной величины потенциала такое соотношение скоростей возможно лишь в том случае, если скорость разряда водородных ионов на ту же величину больше скорости обратного процесса, то есть:
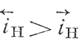
Скорость коррозии iс можно представить как разность между скоростью ионизации и скоростью разряда металлических ионов (уравнение 8) :
![]() (8)
(8)
Поскольку для процесса коррозии справедливо уравнение 3, то вместо уравнения 8 можно написать уравнение 9 и определить скорость коррозии как разницу между скоростями разряда ионов водорода и ионизации его молекул.
![]() (9)
(9)
Это позволяет вычислить скорость коррозионного разрушения металла по данным, относящимся к кинетике реакции выделения и ионизации водорода в коррозионных условиях [1,2].
Информация о химии
Yb — Иттербий
ИТТЕРБИЙ (лат. Ytterbium), Yb, химический элемент III группы периодической системы, атомный номер 70, атомная масса 173,04; относится к лантаноидам. Свойства: металл. Плотность 7,02 г/см3, tпл 824 °С. Название: о названии см ...
Ba — Барий
БАРИЙ (лат. Barium), Ba, химический элемент II группы периодической системы, атомный номер 56, атомная масса 137,33; относится к щелочноземельным металлам. Свойства: серебристо-белый мягкий металл. Плотность 3,78 г/см3, tпл 727 & ...
Pr — Празеодим
ПРАЗЕОДИМ (лат. Praseodymium), Pr, химический элемент III группы периодической системы Менделеева, атомный номер 59, атомная масса 140,9077. Относится к лантаноидам. Свойства: металл, плотность 6,475 г/см3, tпл 932 °С. Приме ...


