Основы формальной кинетики. Понятия и определения
Рефераты по химии / Теории активации и механизмы элементарного акта / Основы формальной кинетики.
Понятия и определенияСтраница 1
1)
Вещества - участники реакции подразделяют на реагенты и продукты.
2)
В любой момент времени они строго связаны материальным балансом.
3)
Цель кинетического описания химической реакции состоит в количественном прогнозе концентраций всех реагентов и продуктов в любой момент времени от начала превращения до установления равновесия в системе. Основа материального баланса - стехиометрическое уравнение.
4)
Ему строго подчиняются все приращения количеств реагентов и продуктов, и на его основе определяется материальный баланс веществ на любой глубине превращения. Количества веществ принято измерять в молях (ni). При необходимости через них выражают иные массовые характеристики системы.
![]()
2) Материальный баланс реагентов и продуктов на любой глубине превращения учитывается в виде термодинамической координаты реакции (синонимы: степень завершённости, глубина превращения - по
IUPAC
):
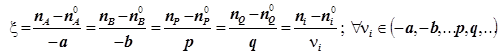 (1.1)
(1.1)
3) Через координату реакции
z
вводятся понятия скорости реакции
v
или
r
(от англ.
rate
). Принято различать:
- скорость реакции в реакционной системе
v
,
- скорость реакции, отнесённую к единице объёма реакционной системы
r
.
Отсюда вытекают некоторые важные определения.
4) Скорость химической реакции в исследуемой системе это первая производная координаты реакции по времени
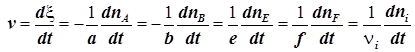 . (1.2)
. (1.2)
5) При изменении объёма реакционной системы эта формула обретает вид:
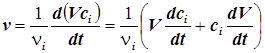 . (1.3)
. (1.3)
6) Скорость химической реакции, отнесённая к единице объёма, - переменная уже более универсальная. Обычно её и называют скоростью реакции:
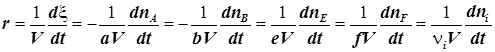 . (1.4)
. (1.4)
7) Скорость реакции, отнесённую к единице объёма, можно представить также в виде:
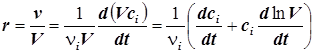 . (1.5)
. (1.5)
8) Скорость реакции, протекающей в статическом реакторе (![]() ), удобно выразить через мольные концентрации (
), удобно выразить через мольные концентрации (
ci
), и формула (1.3) принимает вид:
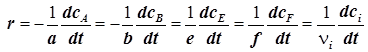 . (1.6)
. (1.6)
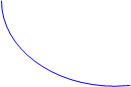
9) Типичные концентрационные функции исчерпания продукта и накопления реагента (кинетические кривые) имеют вид монотонно изменяющихся зависимостей, которые асимптотически приближаются к некоторому определённому пределу. Содержание каждого реагента в системе уменьшается, и содержание каждого продукта увеличивается. В статическом реакторе это выражается в том, что с течением времени концентрации реагентов увеличиваются, а концентрации продуктов уменьшаются. Графики кривых расходования и накопления приводятся на рис.1.
10) При протекании некоторых сложных реакций концентрации отдельных веществ-участников реакции могут изменяться и более сложным образом, в том числе и с признаками периодических изменений системы во времени, например, так, как показано на рисунке справа. Кинетика таких процессов является результатом наложения нескольких простых стадий .(рис.2)
|
B CE, F
Кривая расходования Кривая реагента накопления продукта 0 t 0 t |
Информация о химии
Фармацевтика
Фармацевтика — часть фармации, связанная непосредственно с проблемами производственно-технологического процесса. Термин «фармацевтика» не является синонимом термина «фармация». «Фармацию» ...
Сиборг (Seaborg), Гленн Теодор
Американский химик Гленн Теодор Сиборг родился в Ишпеминге (штат Мичиган), в семье механика Германа Теодора Сиборга и Селмы Оливы (Эриксон) Сиборг, шведов по происхождению. Десять лет спустя Сиборг, его отец, мать и сестра перееха ...
Огромная экономия энергии
В США создали материал который способен удешевить производство почти всего на свете. Ученые разработали новую мембрану с нанопорами, способную быстро и точно разделять молекулы в сложных промышленных условиях. Эта технология может ...