Теория активированного комплекса (ТАК)
Рефераты по химии / Теория активированного комплекса (ТАК)Страница 2
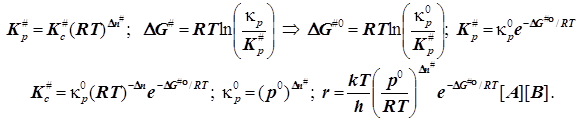
Внимание! Отсюда следует выражение для константы скорости бимолекулярной реакции в ТАК, не вызывающее сомнений в размерности констант скоростей бимолекулярных реакций:
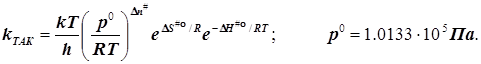 (6.2)
(6.2)
В учебниках чаще всего приводится не столь прозрачное выражение, построенное на иной стандартизации состояний - стандартизуют концентрацию, и в итоге возникает размерность константы скорости, внешне соответствующая моно-, а не би молекулярной реакции. Размерности концентраций оказываются как бы скрыты. У Эйринга, Глесстона и Лейдлера - самих творцов ТАК в книге «Теория абсолютных скоростей реакций» есть анализ, где учтена стандартизация состояний по давлениям. Если стандартным считать состояние с единичными концентрациями реагентов и продуктов, то формулы слегка упростятся, а именно:
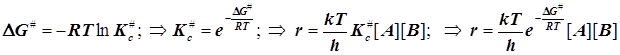 Отсюда следует обычно представленное в учебниках выражение для константы скорости согласно ТАК:
Отсюда следует обычно представленное в учебниках выражение для константы скорости согласно ТАК: ![]() (6.3)
(6.3)
Если не выделить роль стандартного состояния, то теоретическая константа скорости бимолекулярного превращения может обрести чужую размерность, обратную времени, которая будет отвечать мономолекулярной стадии распада активированного комплекса. Активационные величиныS#0 и H#0 нельзя считать обычными термодинамическими функциями состояния. Они не сопоставимы с обычными характеристиками пробега реакции уже потому, что методов их прямого термохимического измерения просто не существует . По этой причине их можно назвать квазитермодинамическими характеристиками процесса активации.
При образовании частицы активированного комплекса из двух исходных частиц имеет место ![]() , и в результате получается
, и в результате получается
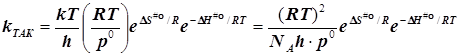 (6.4)
(6.4)
Размерность константы скорости обычная для реакции второго порядка:
![]()
Эмпирическая энергия активации по Аррениусу и её сравнение с близкими
аналогичными активационными параметрами (энергиями) ТАС и ТАК:
Основа - уравнение Аррениуса в дифференциальной форме: ![]()
1) в ТАС получаем:
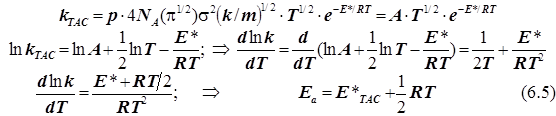
2.1) ТАК. Случай 1. (Общий подход при условии стандартизации концентраций)
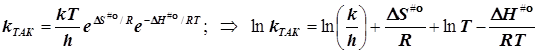
подстановка в уравнение Аррениуса даёт
![]()
2.2) ТАК. Случай 2. (Частный случай бимолекулярной стадии активации ![]() ).
).
Энергия активации по Аррениусу для бимолекулярной реакции:
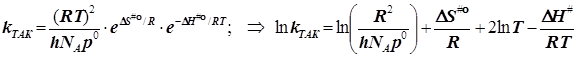
Внимание!!! Полагаем чаще всего ![]()
2.2) Исходя из стандартизации давления, получаем энергию активации:
![]()
![]()
![]() (6.7)
(6.7)
2.3) Это же получается для бимолекулярной реакции и при стандартизации концентрации:
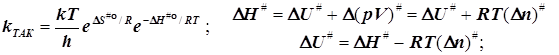 (6.8)
(6.8)
![]()
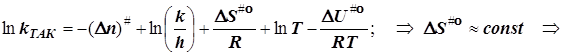
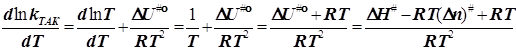
![]()
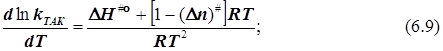
в бимолекулярном акте активации n#= -1, и![]() (6.10)
(6.10)
Результат: Формула, связывающая энергию активации Аррениуса с квазитермодинамическими функциями активации теории переходного состояния, не зависит от выбора стандартного состояния.
3. Адиабатические потенциалы и потенциальные поверхности.
Информация о химии
Химическая термодинамика
Тем временем химики обратились к центральному вопросу физической химии – о влиянии теплоты на химические реакции. К середине 19 в. физики Уильям Томсон (лорд Кельвин), Людвиг Больцман и Джеймс Максвелл выработали новые взгля ...
Tc — Технеций
ТЕХНЕЦИЙ (лат. Technetium), Тс, химический элемент VII группы периодической системы, атомный номер 43, атомная масса 98,9072. Свойства: радиоактивен, наиболее устойчивые изотопы 97Тс и 99Тс (период полураспада соответственно 2,6& ...
Гитон де Морво (Guyton de Morveau), Луи Бернар
Французский химик и политический деятель Луи Бернар Гитон де Морво родился в городе Дижоне, Бургундия. Получил блестящее юридическое образование; уже в восемнадцатилетнем возрасте занял место генерального адвоката при дижонском па ...


