Тема: Металлы
Рефераты по химии / Химический эксперимент по неорганической химии в системе проблемного обучения / Методические рекомендации и разработки содержания школьного химического
эксперимента в системе проблемного обучения / Тема: МеталлыСтраница 1
Приведённые ниже опыты проводятся в 9 классе при изучении темы «Металлы» на уроке № 23 «Генетические ряды Fe2+ и Fe3+» (см. тематическое планирование 9 класс).
Цель работы:
изучить свойства солей железа (III), как окислителей
Форма работы:
фронтальная (демонстрационный эксперимент).
Реактивы и оборудование:
кристаллический хлорид аммония и хлорид железа (Ш), колба Вюрца, известковая вода, лучинка, склянки Дрекселя, спиртовка, индикаторная бумага.
Опыт 1.Взаимодействие хлорида железа (
III) с хлоридом аммония
Хлорид Fe (III) проявляет окислительные свойства по отношению к различным восстановителям. В беседе предшествующей проведению опыта, перед учащимися ставим вопрос: возможно ли химическое взаимодействие между двумя кристаллическими солями хлоридом железа трехвалентного и хлоридом аммония? В поиске ответа на данный вопрос ученики обращаются к таблице растворимости, так как, им известно, что соли взаимодействуют между собой при условии, что они хорошо растворимы, а в результате реакции обмена получается новая нерастворимая соль. В процессе беседы учитель поясняет, что таблицу растворимости в данном случае, при использовании кристаллических вещест, применять нельзя. Таким образом, предварительное обсуждение приводит учащихся к выводу о невозможности химического взаимодействия между указанными веществами.
Далее проводим эксперимент. Он представляет интерес не только для выяснения окислительных свойств хлорида железа (III), но и как способ получения азота в лабораторных условиях.
Ход опыта:
В соответствии с стехиометрическими коэффициентами в уравнении реакции: 6FeCl3 + 2NH4Cl = 6FeCl2 + 8HCl + N2, учитель готовит смесь кристаллических солей хлорида железа (III) и хлорида аммония. Эту смесь помещают в колбу Вюрца, которую соединяют с двумя склянками Дрекселя, заполненными водой (рис. 1). Промывные склянки необходимы для того, чтобы поглотить выделяющийся в ходе реакции хлороводород. Соблюдая технику безопасности, проводят нагревание. Образовавшийся азот можно собрать в 2-3 пробирки над водой.
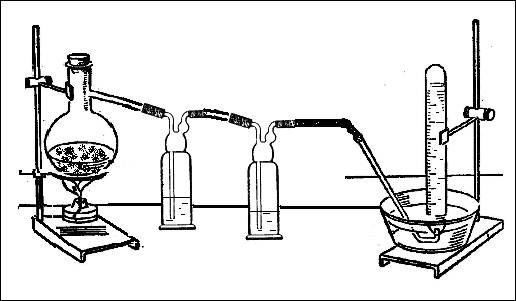
Рис. 1. Взаимодействие хлорида железа (III) с хлоридом аммония
Далее проверяем отсутствие примеси хлороводорода, поднеся влажную индикаторную бумагу к отверстию пробирки с азотом. Она не изменяет цвет. Проводим опыт подтверждающий, что собранный газ действительно азот.
а) В первую пробирку с азотом опускаем горящую лучинку она гаснет, не оставляя даже раскаленного уголька.
б) Во вторую – наливаем известковую воду, в отличие от углекислого газа, известковая вода от азота не мутнеет.
Доказав учащимся, что получен азот, отвергаем их мнение о невозможности взаимодействия хлорида железа (III) с хлоридом аммония.
Создается проблемная ситуация. Далее ученики должны выдвинуть свои предположения о роли каждого вещества в данной химической реакции. Анализ состава исходных веществ и результатов опыта приводит к выводу, что хлорид железа (III) выступает в роли окислителя, а соль аммония, имея в своем составе атомы азота в низшей степени окисления (– 3), проявляет восстановительные свойства. Подтверждаем этот вывод и напоминаем учащимся другие примеры проявления данными веществами указанных свойств. Затем предлагаем учащимся самостоятельную работу по составлению уравнения окислительно-восстановительной реакции между хлоридом железа (III) и хлоридом аммония. При составлении уравнения реакции учащиеся должны учесть, что один из продуктов реакции – хлороводород.
Информация о химии
Mo — Молибден
МОЛИБДЕН (лат. Molybdaenum), Мо, химический элемент VI группы периодической системы, атомный номер 42, атомная масса 95,94. Свойства: светло-серый металл, плотность 10,2 г/см3, tпл 2623 °С. Химически стоек (на воздухе окисляе ...
Дю Виньо (du Vigneaud) Винсент
Американский биохимик Винсент дю Виньо родился в Чикаго (штат Иллинойс) в семье Альфреда дю Виньо, изобретателя и конструктора машин, и Мэри Терезы (в девичестве О'Лири) дю Виньо. Начальное образование он получил в чикагских госу ...
Праут (Prout), Уильям
Английский врач и химик Уильям Праут родился в Хортоне (Глостершир). В 1811 г. он окончил Эдинбургский университет, получив степень доктора медицины. Будучи практикующим врачом в Лондоне, самостоятельно занимался исследованиями в ...


