Методы получения дисперсных систем
Рефераты по химии / Методы получения дисперсных системСтраница 3
i · C · R · T,
где i – изотонический коэффициент, рассчитываемый как отношение суммы чисел ионов и непродиссоциировавших молекул электролита к начальному числу молекул этого вещества.
Так, если степень диссоциации электролита, т.е. отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества, равна и молекула электролита распадается при этом на n ионов, то изотонический коэффициент рассчитывается следующим образом:
i = 1 + (n – 1) · ,(i > 1).
Для сильных электролитов можно принять = 1, тогда i = n, и коэффициент i (также больше 1) носит название осмотического коэффициента.
Явление осмоса имеет большое значение для растительных и животных организмов, поскольку оболочки их клеток по отношению к растворам многих веществ обладают свойствами полупроницаемой мембраны. В чистой воде клетка сильно набухает, в ряде случаев вплоть до разрыва оболочки, а в растворах с высокой концентрацией солей, наоборот, уменьшается в размерах и сморщивается из-за большой потери воды. Поэтому при консервировании пищевых продуктов к ним добавляется большое количество соли или сахара. Клетки микроорганизмов в таких условиях теряют значительное количество воды и гибнут.
Осмотическое давление обеспечивает движение воды в растениях за счет различия осмотических давлений между клеточным соком корней растений (5-20 бар) и почвенным раствором, дополнительно разбавляемом при поливе. Осмотическое давление обусловливает в растении подъем воды от корней до вершины. Таким образом, клетки листьев, теряя воду, осмотически всасывают ее из клеток стебля, а последние берут ее из клеток корня.
49. Рассчитать ЭДС медно-цинкового гальванического элемента, в котором концентрация ионов С
u
2 +
равна 0,001 моль/л, а ионов
Zn
2+
0,1 моль/л. При расчетах учтите стандартные значения ЭДС:
ε о (Zn 2+ /Zn 0) = – 0,74 В и ε о (Cu 2 + /Cu 0) = + 0,34 В.
Для расчета величины ЭДС используется уравнение Нернста 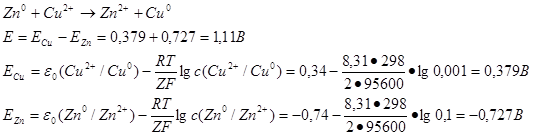
54. Методы получения дисперсных систем, их классификация и краткая характеристика. Какой метод получения дисперсных систем с термодинамической точки зрения наиболее выгоден?
Метод диспергирования. Заключается в механическом дроблении твердых тел до заданной дисперсности; диспергирование ультразвуковыми колебаниями; электрическое диспергирование под действием переменного и постоянного тока. Для получения дисперсных систем методом диспергирования широко используют механические аппараты: дробилки, мельницы, ступки, вальцы, краскотерки, встряхиватели. Жидкости распыляются и разбрызгиваются с помощью форсунок, волчков, вращающихся дисков, центрифуг. Диспергирование газов осуществляют главным образом с помощью барботирования их через жидкость. В пенополимерах, пенобетоне, пеногипсе газы получают с помощью веществ, выделяющих газ при повышенной температуре или в химических реакциях.
Несмотря на широкое применение диспергационных методов, они не могут быть применимы для получения дисперсных систем с размером частиц -100 нм. Такие системы получают кондесационными методами.
В основе конденсационных методов лежит процесс образования дисперсной фазы из веществ, находящихся в молекулярном или ионном состоянии. Необходимое требование при этом методе – создание пересыщенного раствора, из которого должна быть получена коллоидная система. Этого можно достичь при определенных физических или химических условиях.
Физические методы конденсации:
1) охлаждение паров жидкостей или твердых тел при адиабатическом расширении или смешивании их с большим объемом воздуха;
Информация о химии
At — Астат
АСТАТ (лат. Astatium), At, химический элемент VII группы периодической системы, атомный номер 85, атомная масса 209, 9871, относится к галогенам. Свойства: по одним свойствам напоминает неметалл иод, по другим металл полоний. Рад ...
C — Углерод
УГЛЕРОД (лат. Carboneum), С, химический. элемент IV группы периодической системы Менделеева, атомный номер 6, атомная масса 12,011. Свойства: при обычных условиях углерод химически инертен; при высоких температурах соединяется с ...
Робинсон (Robinson), Роберт
Английский химик Роберт Робинсон родился в имении Рафферд, неподалеку от Честерфилда (графство Дербишир). Он был старшим из пяти детей Уильяма Брэбери Робинсона и его второй жены Джейн (Дэйвинпорт) Робинсон. С 1874 г. семья Робинс ...


