Методы экстракции в исследовании равновесий
Рефераты по химии / Методы экстракции в исследовании равновесийСтраница 3
Экспериментальная техника экстракции очень проста. Очень важно, чтобы обе жидкости были взаимно насыщены до экстракции. Для оценки константы равновесия распределение вещества должно быть определено в зависимости от изменения концентрации компонентов реакции экстракции. Каждое значение этой функции, т. е. каждая точка кривой распределения, определяется отдельным экспериментом. Недавно Рейнгард и Ридберг создали «прибор для непрерывного измерения экстракционных коэффициентов распределения». Этот прибор в настоящее время коммерчески доступен под наименованием AKUFVE — название прибора — начальные буквы слов, составляющих приведенную выше фразу в кавычках на шведском языке.
Прибор является одним из тех, который обладает исключительно большими возможностями для изучения равновесий комплексообразования, можно сказать, что создание автоматической аппаратуры для исследования экстракции представляет собой очень важное достижение.
Число работ по различным аспектам применения экстракции в химии растворов огромно, но здесь можно напомнить только о некоторых классических и наиболее важных.
1. Распределение лиганда
Если экстрагируется нейтральный лиганд или сопряженная ему кислота, в то время как комплекс металла не экстрагируется, то об образовании комплекса можно судить по изменению распределения лиганда в зависимости от концентрации иона металла (или лиганда).
Доусон и Мак-Грей уже в 1900 г. изучили образование аммиачных комплексов меди(II), исследуя распределение аммиака между водным раствором и органическими растворителями. Позднее этот же метод был использован для исследования комплексов гидразина, пиридина, анилина, ненасыщенных углеводородов
и комплексов (С2Н50)2РООН.
2. Распределение комплексов металлов
Экстрагируемость ионов металлов и комплексов металлов различными растворителями определяется многими условиями. Если лиганд заряжен и в процессе последовательного комплексообразования образуется электронейтральный комплекс, то этот комплекс может извлекаться органическим растворителем с низкой диэлектрической постоянной. Иногда этот незаряженный комплекс является последним в серии последовательно образующихся комплексов, но отмечены случаи, когда имеет место даль-
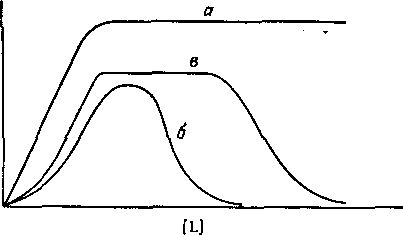
Рис. 1. Зависимость коэффициента распределения q экстрагируемого соединения от концентрации свободного лиганда.
а — образуется координационно насыщенный электроне игральны и комплекс;
6 -- а системе образуется анионный комплекс; в — образуется очень устойчивый электроне игральный комплекс с последующим образованием анионного комплекса.
нейшее присоединение лигандов с последующим образованием комплексных анионов.
В большинстве случаев анионные комплексы не экстрагируются, так что вид кривой распределения комплекса от концентрации лиганда будет разным в зависимости от того, образуется ли в системе анионный комплекс или нет. Коэффициент распределения представляет собой отношение общей концентрации металлсодержащих частиц в обеих фазах:
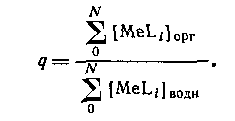
Если MeLm является единственным комплексом, присутствующим в значительных количествах в органической фазе, то
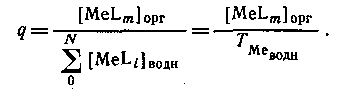
Следовательно, если m = N, то q([L]) представляет собой монотонную функцию, в то время как при N>m эта функция имеет максимум. Если устойчивость нейтрального комплекса достаточно велика, то функция q от [L] имеет отчетливо выраженное плато. Учитывая, что константа распределения соединения MeLm определяется уравнением
Информация о химии
Бэкон (Bacon), Роджер
Английский философ и естествоиспытатель Роджер Бэкон родился в Илчестере (графство Сомерсет). Получил образование в Оксфордском и Парижском университетах (магистр искусств, 1241). До 1247 г. преподавал в Парижском университете. Во ...
Mo — Молибден
МОЛИБДЕН (лат. Molybdaenum), Мо, химический элемент VI группы периодической системы, атомный номер 42, атомная масса 95,94. Свойства: светло-серый металл, плотность 10,2 г/см3, tпл 2623 °С. Химически стоек (на воздухе окисляе ...
Гриньяр (Grignard), Виктор
Французский химик Франсуа Огюст Виктор Гриньяр родился в г. Шербур в семье Теофила Анри Гриньяра и Мари (в девичестве Эбер) Гриньяр. Его отец шил паруса, впоследствии стал мастером местного морского цейхгауза. Мальчик посещал Шерб ...


