Микроэмульсионный метод получения оксида цинка
Рефераты по химии / Микроэмульсионный метод получения оксида цинкаСтраница 8
2.1 Определение критической концентрации мицеллообразования поверхностно – активных веществ (ПАВ) различными методами
В водных растворах коллоидных ПАВ при очень низких концентрациях, соответствующих критической концентрации мицеллообразования (ККМ), образуются сферические мицеллы, которые содержат от 20 до 100 молекул и характеризуются узким распределением частиц по размерам. При увеличении концентрации ПАВ происходит переход мицеллы из одной формы в другую (цилиндрическую, дискообразную и т. д.) при соответствующей критической концентрации ККМ2, ККМ3 и т. д.
В работе для определения ККМ используется кондуктометрический метод и метод, основанный на измерении поверхностного натяжения.
Кондуктометрическое определение ККМ основано на измерении концентрационной зависимости электропроводности растворов ионогенных ПАВ. В области концентраций до ККМ зависимости удельной и эквивалентной электропроводности от концентрации ПАВ соответствуют аналогичным зависимостям для растворов средних по силе электролитов. При концентрации, соответствующей ККМ, на графиках зависимостей наблюдается излом, обусловленный образованием сферических ионных мицелл. Подвижность ионных мицелл меньше подвижности ионов и, кроме того, значительная часть противоионов находится в плотном слое Гельмгольца, что существенно уменьшает электропроводность раствора ПАВ. Поэтому при увеличении концентрации ПАВ больше ККМ эквивалентная электропроводность более резко уменьшается, а возрастание удельной электропроводности значительно ослабляется.
По изменению удельной электропроводности χ можно также определить ККМ2 (рисунок 10).
Поверхностное натяжение водных растворов ПАВ уменьшается с ростом концентрации вплоть до ККМ. Изотерма σ = f ( ln cПАВ ) в области низких концентраций ПАВ имеет криволинейный участок, на котором в соответствии с уравнением Гиббса адсорбция на межфазной границе возрастает с ростом концентрации. При определенной концентрации cm криволинейный участок изотермы переходит в прямую с постоянным значением dσ / d ln c, т. е. адсорбция достигает постоянного и максимального значения. В этой области на межфазной границе формируется насыщенный мономолекулярный адсорбционный слой. При дальнейшем увеличении концентрации ПАВ (cПАВ > ККМ) в объеме раствора образуются мицеллы и поверхностное натяжение практически не изменяется. ККМ определяется по излому изотермы при выходе ее на участок, параллельной оси ln c.
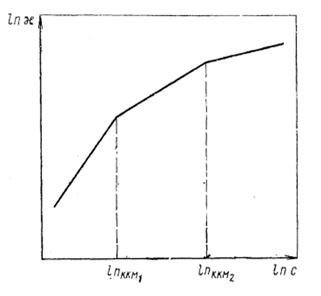
Измерение поверхностного натяжения позволяет определять ККМ как ионогенных, так и неионных ПАВ.
Рисунок 10 – Зависимость удельной электропроводности раствора χ ионогенного ПАВ от его концентрации.
Исследуемые ПАВ необходимо тщательно очищать от примесей, поскольку их присутствие может явиться причиной появления минимума на изотерме при концентрациях, близких к ККМ.
2.2 Определение ККМ в растворе ПАВ кондуктометрическим методом
Для проведения работы применяли:
– прибор для измерения электропроводности водных растворов, например мост переменного тока Р – 577;
– кондуктометрическая ячейка с платиновыми электродами;
– мерные колбы емкостью 100 мл;
– пипетки емкостью 25 мл;
– раствор ионогенного ПАВ, цетил триметил бромид аммония;
– 0,02 М водный раствор KCl.
Предварительно определяли константу кондуктометрической ячейки. В ячейку наливали такой объем раствора KCl точно известной концентрации, чтобы электроды были полностью погружены в него. Ячейку помещали в термостат, термостатировали 4 – 5 мин, подключали электроды к клеммам кондуктометра и измеряли сопротивление R0 раствора KCl между электродами. Константу K рассчитывали по формуле:
K = χ0 R0 ,
где χ0 – удельная электропроводность раствора KCl при температуре опыта.
Таблица 2.2 – Значения удельной электропроводности 0,01 М раствора KCl при различных температурах
|
t, °С |
χ, См·м –1 |
t, °С |
χ, См·м –1 |
|
16 |
0,1173 |
21 |
0,1305 |
|
17 |
0,1199 |
22 |
0,1332 |
|
18 |
0,1225 |
23 |
0,1359 |
|
19 |
0,1251 |
24 |
0,1386 |
|
20 |
0,1278 |
25 |
0,1413 |
Информация о химии
Корнфорт (Cornforth), Джон Уоркап
Австралийский химик-органик Джон Уоркап Корнфорт родился в Сиднее, в семье англичанина Дж.У. Корнфорта и уроженки Австралии Хильды (Эйппер) Корнфорт, чьи родители по происхождению были немцами. В детстве Корнфорт жил в Сиднее и в ...
Физико-химия конкретных промышленных каталитческих процессов
Окислительный аммонолиз пропилена. Окислительное хлорирование этилена. Основные особенности процессов окисления в псевдоожиженном слое катализатора. «Воздушный» и «кислородный» процессы. Рециркуляционные технологии. Кин ...
Cd — Кадмий
КАДМИЙ (лат. Cadmium), Cd, химический элемент II группы периодической системы, атомный номер 48, атомная масса 112,41. Свойства: серебристый металл с синеватым отливом, мягкий и легкоплавкий; плотность 8,65 г/см3, tпл 321,1 ° ...


