Первое начало термодинамики и его применение
Рефераты по химии / Первое начало термодинамики и его применениеСтраница 2
Первое начало термодинамики непосредственно связано с законом сохранения энергии и утверждает, что в любой изолированной системе запас энергии остаётся постоянным. Отсюда следует закон эквивалентности различных форм энергии: разные формы энергии переходят друг в друга в строго эквивалентных количествах. Первое начало можно выразить и в такой форме: вечный двигатель первого рода невозможен, т. е. невозможно построить машину, которая давала бы механическую работу, не затрачивая на это соответствующего количества молекулярной энергии; или внутренняя энергия является функцией состояния, т. е. ее изменение не зависит от пути процесса, а зависит только от начального и конечного состояния системы.
Докажем, что внутренняя энергия является функцией состояния. Пусть при переходе системы из первого состояния во второе по одному пути изменение внутренней энергии равно ΔU а, а по другому пути — ΔUb, т. е. предположим вначале, что изменение внутренней энергии зависит от пути процесса. Если величины ΔU а и ΔUb различны, то, изолируя систему и переходя из состояния 7 в состояние 2 одним путчем, а затем обратно из состояния 2 в состояние 1 другим путем, получали бы выигрыш или потерю энергии ΔUb — ΔU а - но по условию система изолированная, т. е. она не обменивается теплом и работой с окружающей средой и запас ее энергии согласно первому началу термодинамики должен быть постоянным. Таким образом, сделанное предположение ошибочно. Изменение внутренней энергии при переходе системы из состояния 1 в состояние 2 не зависит от пути процесса, т. е. внутренняя энергия является функцией состояния.
Изменение внутренней энергии ΔU системы может происходить за счет обмена теплотой Q и работой А с окружающей средой. Условились считать положительными величинами теплоту, полученную системой и работу, совершенную системой. Тогда из первого начале термодинамики следует что полученная системой извне теплота Q расходуется на приращение внутренней энергии ΔU и работу А, совершенную системой, т, е.
Q = ΔU + A. (II, 1)
Уравнение (II, 1) представляет собой математическую формулировку первого начала термодинамики. Величины ΔU, Q и А в уравнении (II, 1) могут иметь как положительное, так и отрицательное значение в зависимости от характера процесса. Если, например, все три величины отрицательны, то это означает, что отданная системой внешней среде теплота равна убыли внутренней энергии плюс полученная системой работа.
В отличие от внутренней энергии, теплота Q и работа А не являются функциями состояния, они зависят от пути процесса. Разность их
Q- A= ΔU (II, 2)
от пути процесса не зависит. Для бесконечно малого изменения этих величин имеем
термодинамика эндотермический реакция
δQ = dU + δA, (II,3)
где dU — полный дифференциал внутренней энергии системы; δQ — бесконечно малое количество теплоты; δА — бесконечно малое количество работы.
Работа расширения идеального газа в разных процессах
Для многих систем единственный вид работы — работа расширения. Практическое значение имеет обычно работа расширения газа, причем многие газы при достаточно низких давлениях и сравнительно высоких температурах приближенно подчиняются законам идеальных газов. Рассмотрим математические соотношения для вычисления работы расширения идеального газа в разных процессах. При расширении газа совершается работа, которая вычисляется по уравнению
δA=pdv, (II,5)
или в интегральной форме
A=![]() , (11,6)
, (11,6)
Интегрирование уравнения (II, 6) возможно только для процесса расширения или сжатия газа в условиях, близких к равновесным. Совершаемая при этом работа является наибольшей и называется максимальной работой.
Для интегрирования уравнения (II, 6) нужно знать зависимость между давлением и объемом газа, т. е. уравнение состояния газа.
Эта зависимость для идеального газа описывается уравнением состояния Менделеева — Клапейрона:
pv = nRT, (11,7)
где n — число молей идеального газа; R— универсальная газовая постоянная, равная 8,314 дж/моль-град.
Рассмотрим выражения для максимальной работы расширения идеального газа в пяти процессах: изобарном, изотермном, адиабатном, изохорном и изобарно-изотермном.
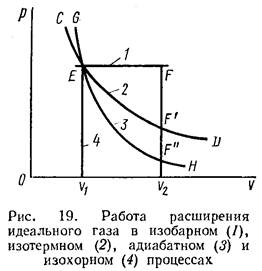
1. Изобарный процесс осуществляется при постоянном давлении (р = const). При этом из уравнения (II, 6) получаем
A = p(υ2- υ1). (II,8)
Учитывая, что pv2 = nRT2 и pv1 = nRT1 имеем
A=nR(T2-T1) (11,9)
2. Изотермный процесс протекает при постоянной температуре (T=const). Подставляя в уравнение (II, 6) вместо р величину nRT/v из (II, 7), получим после интегрирования
Информация о химии
Больцман (Boltzmann), Людвиг
Австрийский физик Людвиг Больцман родился в Вене в семье служащего. По окончании гимназии в Линце он поступил в Венский университет, где учился у Й.Стефана и Й.Лошмидта. В 1866 г. Больцман защитил докторскую диссертацию, работал а ...
Аллетрин
Брутто-формула (система Хилла): C19H26O3 Молекулярная масса (в а.е.м.): 302,40794 Растворимость (в г/100 г или характеристика): вода: не растворим Плотность: 1,0048 (25°C, г/см3) Показатель преломления (для D-линии натри ...
Фишер (Fischer), Ганс
Немецкий химик Ганс Фишер родился в г. Хехст-на-Майне в семье Анны Фишер (в девичестве Гердеген) и Эйгена Фишера, химика по специальности и директора фабрики и фирмы «Калле» по производству красителей. После окончания ...


