Производство неконцентрированной азотной кислоты
Рефераты по химии / Производство неконцентрированной азотной кислотыСтраница 22
2)Тепло окисления монооксида азота в диоксид:
Q2= 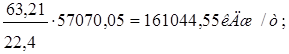
где 57070,05- теплота окисления монооксида азота в диоксид, кДж/кмоль;
3)Тепло образования моногидрата:
Q3= 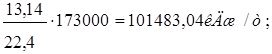
где 173000-теплота образования азотной кислоты, кДж/кмоль;
13,14-количество сконденсировавшихся паров воды, кг/т;
4)Тепло разбавления моногидрата:
Q4= 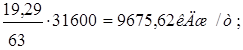
где 19,29-количество растворенного моногидрата азотной кислоты,кг;
31600-теплота разбавления моногидрата кислоты, кДж/кмоль;
5)Тепло конденсации воды:
Q5=![]() ;
;
Где 4939,6-тепло конденсации воды, кДж/кмоль;
Общий приход тепла: ![]() Q=1593275,84кДж/т;
Q=1593275,84кДж/т;
Расход тепла:
Рассчитаем теплоемкости компонентов газовой смеси на выходе в холодильник-конденсатор при температуре 55![]() или 328К.
или 328К.
Теплоемкость кислорода: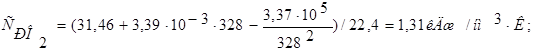
Теплоемкость азота:
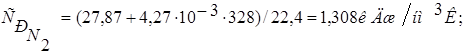
Теплоемкость воды:
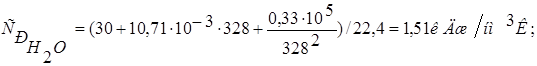
Теплоемкость оксида азота (II):
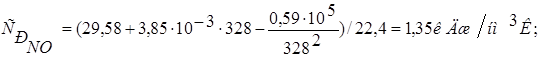
Теплоемкость оксида азота (IV):
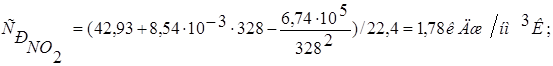
Средняя теплоемкость нитрозного газа на выходе из аппарата:
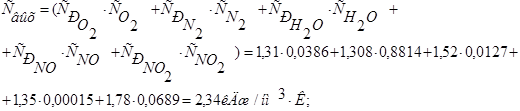
1)Тепло, уходящее с нитрозным газом:
Q1’= ![]() =
= ![]()
где ![]() - температура нитрозного газа на выходе из холодильника, 0С ;
- температура нитрозного газа на выходе из холодильника, 0С ;
2)Тепло, уходящее с кислотой:
Q2’ =mk ![]() Ck
Ck ![]() tk =
tk =![]() где
где
mk-масса кислоты, кг/т;
Ck-теплоемкость кислоты, кДж/кмоль;
tk- температура кислоты,![]()
3) Теплопотери:
Принимаем, что потери тепла в окружающую среду составляют 3% от общего количества, поступающего в аппарат.
Q3’=![]()
4)Тепло отводимое с охлаждающей водой;
Q4’= ![]() Q-( Q1’+ Q2’+ Q3’)=
Q-( Q1’+ Q2’+ Q3’)=
![]() ;
;
Таблица 3.3.2.1
Тепловой баланс холодильника-конденсатора.
|
Статьи прихода |
кДж/т |
% |
Статьи расхода |
кДж/т |
% |
|
1) Тепло с газами |
670122,29 |
42,05 |
1)Тепло с газами |
483545,21 |
30,34 |
|
2) Тепло окисления |
161044,55 |
10,11 |
2)Тепло с кислотой |
3085,24 |
0,19 |
|
3) Тепло образования моногидрата |
101483,04 |
6,37 |
3)Теплопотери |
47798,27 |
2,99 |
|
4) Тепло разбавления моногидрата |
9675,62 |
0,61 |
4)Тепло, уходящее с водой |
1058847,12 |
66,46 |
|
5) Тепло конденсации воды |
650950,34 |
40,86 | |||
|
Итого: |
1593275,84 |
100 |
Итого: |
1593275,84 |
100 |
Информация о химии
Гесс (Hess), Герман Иванович (Герман Генрих)
Русский химик Герман Иванович (Герман Генрих) Гесс родился в Женеве в семье художника, который вскоре переехал в Россию. В 15-летнем возрасте Геcc уезжает в Дерпт (ныне Тарту, Эстония), где учится сначала в частной школе, а затем ...
Материаловедение
Материаловедение — междисциплинарный раздел науки, изучающий изменения свойств материалов, как в твёрдом, так и в жидком состоянии в зависимости от некоторых факторов. К изучаемым свойствам относятся структура веществ, элект ...
Жолио (Joliot), Жан Фредерик
Французский физик Жан Фредерик Жолио родился в Париже. Он был младшим из шести детей в семье процветающего коммерсанта Анри Жолио и Эмилии (Родерер) Жолио, которая происходила из зажиточной протестантской семьи из Эльзаса. В 1910 ...


