Электрохимические процессы. Электролиз расплавов и растворов электролитов. Инертные и растворимые электроды. Законы Фарадея
Рефераты по химии / Общая и неорганическая химия / Электрохимические процессы. Электролиз расплавов и растворов электролитов.
Инертные и растворимые электроды. Законы ФарадеяСтраница 2
На катоде в первую очередь восстанавливаются (принимают электроны) катионы с наиболее высокими (максимальными) значениями электродного потенциала (сильные окислители).
1. Если электродный потенциал катиона j°Me/Men+ < -1,6 В, то на катоде восстанавливаются ионы H+ молекулы H2O с выделением H2 и
2. накоплением в растворе OH-:
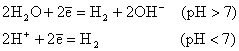
3. При значении стандартного электродного потенциала катиона ![]() на катоде восстанавливаются только ионы металла, а разряд ионов H+ не происходит:
на катоде восстанавливаются только ионы металла, а разряд ионов H+ не происходит: ![]()
4. Если -1,6 В <j°Me/Men+ < 0 В, то на катоде протекают два процесса: восстановление ионов Н+ и ионов металла. Это обусловлено тем, что, во-первых, потенциал водородного электрода зависит от рН раствора:
jH2/2H+ = -0,059· pH,
во-вторых, выделение водорода на катоде происходит с более высоким перенапряжением по сравнению с перенапряжением разряда многих металлов.
Таким образом, при некоторой плотности тока потенциал выделения водорода становится отрицательнее, чем потенциал выделения металла (рис.8.15).
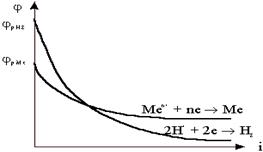
Высокое водородное перенапряжение - явление положительное, благодаря этому, из водных растворов удается выделять на катоде марганец, цинк, хром, железо, кадмий, кобальт, никель и другие металлы. Все вышесказанное можно представить следующей схемой:
ЗАКОНЫ ЭЛЕКТРОЛИЗА
Количественные соотношения при электролизе были исследованы английским физиком М. Фарадеем и описаны двумя законами.
Первый закон Фарадея. Масса веществ, выделяющихся на электродах, прямо пропорциональна количеству электричества, прошедшего через электролит.
m = k· Q, где
Q - количество электричества (Кл),
k - константа, электрохимический эквивалент.
Так как Q = I· t, то m = k· I· t, где
I - сила тока в амперах (А);
t - продолжительность электролиза в секундах (с).
Второй закон Фарадея. Равные количества электричества выделяют при электролизе из различных электролитов эквивалентные количества вещества.
nэк.(A) = nэк.(B) или
![]()
Для восстановления на катоде и окисления на аноде 1 моль эквивалентов вещества через электролит должно пройти 96500 кулонов электричества. Это количество электричества называют числом Фарадея (F).
F = I· t = 96500 Кл/моль.
Оба закона можно свести в одну формулу:
![]() где m - масса вещества (г);
где m - масса вещества (г);
Mэк. - молярная масса эквивалентов выделившегося вещества (г/моль); ![]() где M - молярная масса выделившегося вещества (г/моль);
где M - молярная масса выделившегося вещества (г/моль);
Z - число эквивалентности, равное числу электронов, участвующих в процессе окисления или восстановления на электродах при получении 1 моль вещества.
Если необходимо рассчитать объем газа, выделившегося в процессе электролиза, то выражение законов Фарадея может быть записано следующим образом
![]()
где V° - объем выделившегося газа при н.у., (л);
Vэк. - молярный объем эквивалентов газа (л/моль);
![]()
где Vm - молярный объем газа, равный 22.4 л/моль.
В случае параллельных процессов часть количества электричества расходуется на выделение одного вещества, часть - на выделение другого. Доля общего количества электричества (в процентах), которая расходуется на выделение одного из веществ, называется выходом по току этого вещества:
Информация о химии
Лавуазье (Lavoisier), Антуан Лоран
Антуан Лоран Лавуазье родился 26 августа 1743 г. в Париже в семье адвоката. Первоначальное образование он получил в колледже Мазарини, а в 1864 г. окончил юридический факультет Парижского университета. Уже во время обучения в унив ...
Четыре первоэлемента
Эти представления были объединены в натурфилософии Эмпедокла из Агригента – создателя теории четырех начал мироздания. В различных вариантах его теория властвовала над умами людей более двух тысячелетий. Согласно Эмпедоклу, ...
Fr — Франций
ФРАНЦИЙ (лат. Francium), Fr, химический элемент I группы периодической системы Менделеева, атомный номер 87, атомная масса 223,0197, относится к щелочным металлам. Свойства: радиоактивен, наиболее устойчив изотоп 223Fr (период по ...


