Фазовые равновесия в гетерогенных системах, фазовые превращения и правило фаз. Диаграммы состояния
Рефераты по химии / Общая и неорганическая химия / Фазовые равновесия в гетерогенных системах, фазовые превращения и правило
фаз. Диаграммы состоянияСтраница 2
При изучении твердых тел. состоящих из тугоплавких или разлагающихся при высоких температурах компонентов, применяют такие методы подготовки образцов, как прессование таблеток смесей перед отжигом и промежуточное перетирание смесей при отжиге, отжиг смесей солей или гелей, осажденных из водных или других растворов и т. п.Типы фазовых равновесий. В однокомпонентной системе (при наличии полиморфных превращений) возможны 4 вида двухфазных равновесий: жидкость - пар, кристалл - пар, кристалл - жидкость и кристалл - кристалл; 4 вида трехфазных равновесий: кристалл - жидкость - пар, кристалл - кристалл - жидкость, кристалл - кристалл - пар и кристалл - кристалл - кристалл; при этом не учитывается возможность образования жидких кристаллов. В двойных системах (компоненты А и В) возможны те же виды двухфазных равновесий, но число возможных видов трехфазных равновесий достигает 26 вследствие того, что играет роль не только природа сосуществующих фаз (их агрегатное состояние), но и взаимное расположение фазовых полей на диаграмме состояния в координатах температура - состав (давление предполагается постоянным). Все эти фазовые равновесия делятся на два типа: эвтектическое фазовое равновесие, при которых из трех одновременно участвующих в равновесии фаз при понижении температуры одна испытывает превращение, а две другие при этом образуются, и перитектическое фазовое равновесие, когда две фазы взаимодействуют (превращаются), при этом образуется третья фаза.
В простейшем случае, если на основе компонентов А и В возможно образование жидкого раствора L и двух твердых растворов a и b, эвтектического и перитектического фазовых равновесий можно записать соответственно в виде реакций:
![]()
Поскольку в двойной системе состояние трехфазного равновесия является нонвариантным, эвтектические и перитектические реакции происходят при постоянной температуре, называемой соотв. эвтектической или перитектической, то есть на диаграмме состояния этим равновесиям отвечают горизонтали. В случае, если в определенной области температур и составов все три равновесно сосуществующие фазы являются твердыми (у одного из компонентов существуют полиморфные модификации с образованием твердого раствора g), возможны трехфазные равновесия, называют эвтектоидными и перитектоидными. Их можно представить соответствующими реакциями, аналогично эвтектическим и перитектическим фазовым равновесиям:
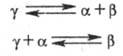
При наличии в некотором температурно-концентрационном интервале двух жидких фаз L1 и L2 и одной твердой (напр., а) возможны трехфазные равновесия, называют монотектическое и синтектическое:
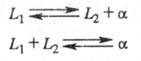
Некоторые виды трехфазных равновесий, например те, при которых образуется жидкость в результате взаимодействием двух кристаллических фаз при понижении температуры, теоретически возможны, но реально, по-видимому, не наблюдаются. При переходе к тройным и более сложным системам число видов многофазных фазовых равновесий возрастает еще больше (см. Тройная точка).Распределение компонентов между фазами системы при фазовом равновесии описывается законом распределения, устанавливающим, что отношение термодинамических активностей примеси в двух фазах при фазовое равновесие является постоянной величиной. В первом приближении активности компонентов можно заменить их концентрациями. Одним из условий выполнимости закона распределения вещества между фазами является одинаковость молекулярного состояния растворенного вещества в обеих фазах, то есть отсутствие ассоциации молекул. Замена активностей на концентрации допустима, если коэффициент активности компонента в обеих фазах не зависят от концентрации, то есть для идеальных растворов (это условие обычно выполняется для очень разбавленных растворов, в случае микроконцентраций). Отношение активностей компонентов называют коэффициентом распределения или коэффициентом относительной летучести и т. п. Частные случаи закона распределения - правила и законы, выражающие равновесное распределение вещества в двухфазных системах. Например, для расчета равновесия жидкости и пара пользуются законами Рауля и Генри, первым - для вещества, находящегося в избытке, вторым - для вещества, являющегося примесью. Распределение растворенного вещества между двумя несмешивающимися жидкостями при постоянной температуре характеризуется тем, что отношение его концентраций в этих двух фазах сохраняется постоянным (закон Бертло - Нернста). Распределение примеси между жидкой и твердой кристаллической фазой описывается распределениями Хлопина (равновесия) и Дёрнера-Хоскинса.Законы распределения являются основой разнообразных гетерогенных методов очистки (разделения), хотя само фазовое равновесие в процессе проведения этих методов очистки достигается далеко не всегда, а иногда сама возможность очистки обусловлена отсутствием фазового равновесия (см. Кристаллизационные методы разделения смесей, Ректификация, Экстракция жидкостная).
Информация о химии
Nb — Ниобий
НИОБИЙ (лат. Niobium), Nb, химический элемент V группы периодической системы, атомный номер 41, атомная масса 92,9064. Свойства: светло-серый тугоплавкий металл, плотность 8,57 г/см3, tпл 2477 °С, температура перехода в сверх ...
Жолио-Кюри (Joliot-Curie), Ирен
Французский физик Ирен Жолио-Кюри родилась в Париже. Она была старшей из двух дочерей Пьера Кюри и Марии Склодовской-Кюри. Мари Кюри впервые получила радий, когда Ирен был всего год. Приблизительно в это же время дед Ирен по линии ...
Бартон (Barton), Дерек Харолд Ричард
Английский химик Дерек Харолд Ричард Бартон родился в Грейвзенде, на берегу Темзы, неподалеку от Лондона, в семье Уильямса Томаса Бартона и Мод (Хенриетты) Бартон. Получив начальное и среднее образование в тонбриджской школе, он с ...


