Строение и физико-химические свойства аскорбиновой кислоты
Рефераты по химии / Технология производства аскорбиновой кислоты (витамина С) / Строение и физико-химические свойства аскорбиновой кислотыСтраница 1
Строение аскорбиновой кислоты следующее:

Аскорбиновая кислота является производным моносахарида L-ряда. Это строение подтверждено синтезами, в которых исходными веществами являются L-сорбоза (наиболее доступна) или L-гулоза, превращающиеся в 2-кето-Ь-гуло-новую кислоту—ключевой полупродукт в синтезе аскорбиновой кислоты:
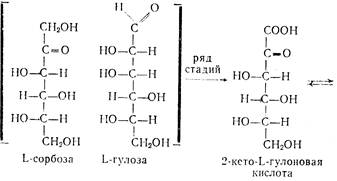 | |||
 | |||
Аскорбиновая кислота имеет два асимметрических атома углерода в положениях 4 и 5 и образует четыре оптических изомера и два рацемата:
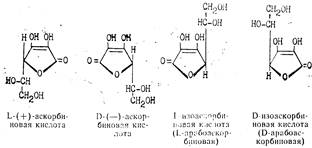
Биологически активной является L-(+)-форма. Д-(—)-форма является антивитамином и не существует в природе. Принятое строение аскорбиновой кислоты подтверждается рентгеноструктурным анализом. Молекулярная модель, установленная этим методом, показывает, что все атомы углерода и кислорода цикла лежат в одной плоскости, кроме С4, лежащего вне ее.
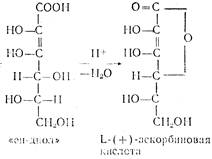
Аскорбиновая кислота представляет собой белое кристаллическое вещество с Тпл 192°, очень чувствительна к нагреванию, хорошо растворима в воде, плохо в спиртах (за исключением метанола), практически нерастворима в неполярных растворителях. Она очень чувствительна к тяжелым металлам, медь и железо разрушающе, действуют на аскорбиновую кислоту. Аскорбиновая кислота легко отщепляет протон гидроксила в положении Сз кольца и по силе не уступает карбоновым кислотам:
Аскорбиновая кислота является двухосновной, однако, ее считают практически одноосновной, поскольку pKI=4 12 а рКII =11,57.
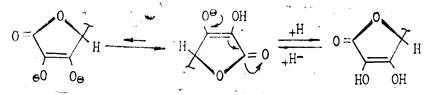
Кислотность обусловлена фенольной НО-группой. Аскорбиновая кислота легко образует соли — наиболее известна ее натриевая соль (аскорбинат натрия). Аскорбиновая кислота очень легко окисляется и обладает сильной восстановительной способностью. Процесс окисления аскорбиновой кислоты протекает сложно, начальной стадией его является образование т. н. дегидроаскорбиновой кислоты под влиянием кислорода воздуха или других окислителей. Этот процесс является обратимым:
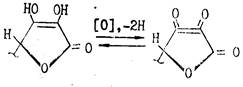
При рН<7 в процессе окислительного и гидролитического расщепления дегидроаскорбиновая кислота, например, превращается в 2,3-дикето-L-гулоновую кислоту. Последняя под влиянием повышенной температуры декарбоксилируется и превращается в L-ксилозон-2. Ксилозон восстанавливается аскорбиновой кислотой в L-ксилозу, которая циклизуется в фурфурол путем дегидратации:
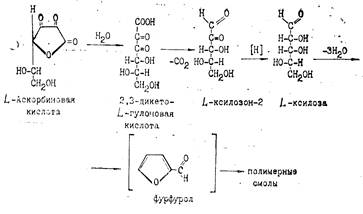
Известно, что фурфурол легко вступает в реакции присоединения, образуя полимеры, а также легко окисляется с раскрытием цикла и образованием янтарной и других органических кислот и смолистых веществ.
Указанные процессы протекают даже в присутствии кислорода воздуха, образуя цикл каталитического разложения аскорбиновой кислоты. Поэтому желательно исключить воздействие кислорода на растворы аскорбиновой кислоты и ее препараты в производстве и при хранении.
Информация о химии
Зоман
Синонимы: EA 1210 GD soman метилфторфосфоновой кислоты пинаколиловый эфир Внешний вид: бесцветн. жидкость Брутто-формула (система Хилла): C7H16FO2P CAS №: 96-64-0 Молекулярная масса (в а.е.м.): 182,17 Температура плавл ...
Беккерель (Becquerel), Антуан Анри
Французский физик Антуан Анри Беккерель родился в Париже. Его отец, Александр Эдмон, и его дед, Антуан Сезар, были известными учеными, профессорами физики в Музее естественной истории в Париже и членами Французской академии наук. ...
Новые методы исследования
Все новые представления о строении вещества могли формироваться только в результате развития в 20 в. экспериментальной техники и появления новых методов исследования. Открытие в 1895 Вильгельмом Конрадом Рентгеном Х-лучей послужил ...


