Физико-химические основы производства Na2CO3
Рефераты по химии / Создание безотходной технологии в производстве кальцинированной соды / Физико-химические основы производства Na2CO3Страница 3
![]() – концентрация активного компонента (не связанного в хлорид и углеаммонийные соли аммиака), н.д.;
– концентрация активного компонента (не связанного в хлорид и углеаммонийные соли аммиака), н.д.;
![]() – константа, включающая константу Генри и частичный коэффициент абсорбции для жидкостной пленки;
– константа, включающая константу Генри и частичный коэффициент абсорбции для жидкостной пленки;
![]() – давление диоксида углерода над метастабильным раствором, кПа;
– давление диоксида углерода над метастабильным раствором, кПа;
![]() – парциальное давление CO2 в карбонизующем газе, кПа.
– парциальное давление CO2 в карбонизующем газе, кПа.
Следует отметить, что температурный режим влияет на процесс образования кристаллов NaHCO3. Для получения крупных кристаллов правильной формы, которые не забивают поверхность вакуум-фильтров и малорастворимые в процессе фильтрации, необходимо поддерживать температуру 60–72 °С в зоне образования и в начальных период роста кристаллов. В процессе дальнейшего роста кристаллов температура уже не оказывает существенного влияния на рост кристаллов. При нормальном росте кристаллов образуются кристаллы типа "бочка", при ухудшении процесса кристаллизации образуются длинные кристаллы склонные к образованию сростков в виде снопов – кристаллы "друза". Такие кристаллы забивают вакуум-фильтры и способствуют тому, что в осадке гидрокарбонат натрия содержится больше воды, чем в кристаллах типа "бочка".
На основе горизонтальной проекции изотермической диаграммы растворимости для 15 °С в системе NaCl–NH4Cl–NH4HCO3–NaHCO3, изученной П.П. Федотьевым (см. рис. 1.1), можно определить оптимальные условия для проведения процесса карбонизации [6]. Они находятся вблизи точки Р1 и линии P1–IV.
Выпавший осадок гидрокарбоната натрия отфильтровывают, и далее его подвергают прокаливанию с получением соды (уравнение 1.5). Температура разложения гидрокарбоната натрия составляет 160–180 °С. Эта операция протекает в отделении кальцинации. Выделяющийся диоксид углерода используется в процессе карбонизации.
I–Р2 – растворы, насыщенные NaHCO3 и NaCl; P2–P1 – растворы, насыщенные NaHCO3 и NaCl; P1–IV – растворы, насыщенные NaHCO3 и NH4HCO3;
P1 – раствор, насыщенный NaHCO3, NH4HCO3 и NH4Cl; Р2 – раствор, насыщенный NaCl, NH4C1 и NaHCO3.
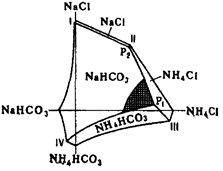
Рис. 1.1 – Диаграмма системы NaCl–NH4Cl–NH4HCO3–NaHCO3
Аммиак обычно регенерируют из хлорида аммония и возвращают в производство. С этой целью раствор, содержащий хлорид аммония подвергают обработке известковым молоком (уравнение 1.4). Образующийся аммиак отгоняют из раствора и направляют на абсорбцию.
Для получения известкового молока необходим оксид кальция, который получают путем обжига карбонатного сырья (мела или известняка) в известково-обжигательных печах при температуре 1100–1200 °С (уравнение 1.1). Образующийся диоксид углерода используют в отделении карбонизации, а СаО используют для получения известкового раствора (уравнение 1.2).
Поступающий сырой рассол (водный раствор хлорида натрия) подвергают предварительной очистке от примесей солей кальция и магния с помощью Na2CO3 и Са(ОН)2. В процессе очистки образуются плохо растворимые Mg(OH); и СаСО3, выпадающие в осадок:
MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2 (1.6)
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl (1.7)
Осадки Mg(OH)2 и СаСО3 удаляют, а очищенный рассол направляют дальше в производство.
Информация о химии
Вальден (Walden), Пауль
Пауль (Павел Иванович) Вальден родился в хуторе Пипены, Розенбекской волости Вольмарского уезда Лифлянской губернии, Россия (ныне – территория Латвии) в многодетной крестьянской семье. По национальности латыш. В 1875 г. Валь ...
Физико-химия конкретных промышленных каталитческих процессов
Окислительный аммонолиз пропилена. Окислительное хлорирование этилена. Основные особенности процессов окисления в псевдоожиженном слое катализатора. «Воздушный» и «кислородный» процессы. Рециркуляционные технологии. Кин ...
Br — Бром
БРОМ (лат. Bromum), Br, химический элемент VII группы периодической системы, атомный номер 35, атомная масса 79,904, относится к галогенам. Природный бром представляет смесь двух нуклидов с массовыми числами 79 (в смеси 50,56% по ...


