Общие сведения по давлению паров
Рефераты по химии / Понятие давления паров и теплоты / Общие сведения по давлению паров
Согласно правилу фаз, давление паров чистой жидкости является однозначной функцией температуры насыщения, поэтому почти все данные о давлении паров представляют в виде зависимости
![]() .(7.1)
.(7.1)
Давление насыщенного пара ![]() может быть связано с любым другим интенсивным свойством насыщенной жидкости (или пара), однако температура насыщения в этом случае наиболее удобна. Если паровая фаза находится в равновесии с жидкой фазой, то условие равенства химических потенциалов, температуры и давления обеих фаз приводит к уравнению Клаузиуса-Клапейрона:
может быть связано с любым другим интенсивным свойством насыщенной жидкости (или пара), однако температура насыщения в этом случае наиболее удобна. Если паровая фаза находится в равновесии с жидкой фазой, то условие равенства химических потенциалов, температуры и давления обеих фаз приводит к уравнению Клаузиуса-Клапейрона:
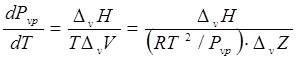 (7.2)
(7.2)
или
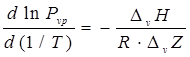 .(7.3)
.(7.3)
Большинство уравнений для расчета и корреляции давления паров получаются путем интегрирования уравнения (7.3). После интегрирования должна быть выбрана форма зависимости группы ![]() от температуры, а константа интегрирования определяется по одной точке “давление паров -температура”.
от температуры, а константа интегрирования определяется по одной точке “давление паров -температура”.
В общем случае зависимость ![]() от
от ![]() имеет S-образный вид. Для большинства веществ изменение наклона соответствует значению приведенной температуры
имеет S-образный вид. Для большинства веществ изменение наклона соответствует значению приведенной температуры ![]() =0,8-0,85. Для низкокипящих или неполярных соединений эта величина имеет более низкое значение (для метана точка перегиба
=0,8-0,85. Для низкокипящих или неполярных соединений эта величина имеет более низкое значение (для метана точка перегиба ![]() =0,7), для высококипящих, а также для полярных или ассоциированных жидкостей точка перегиба перемещается в область более высоких значений Tr (для этанола – 1,0).
=0,7), для высококипящих, а также для полярных или ассоциированных жидкостей точка перегиба перемещается в область более высоких значений Tr (для этанола – 1,0).
S-образный вид зависимости ![]() от
от ![]() обусловлен изменением отношения
обусловлен изменением отношения ![]() с температурой. Для нормальных жидкостей это отношение сравнительно нечувствительно к изменению температуры в диапазоне между нормальной температурой кипения вещества и его критической температурой. Объясняется это тем, что уменьшение теплоты парообразования компенсируется в некоторой степени уменьшением величины
с температурой. Для нормальных жидкостей это отношение сравнительно нечувствительно к изменению температуры в диапазоне между нормальной температурой кипения вещества и его критической температурой. Объясняется это тем, что уменьшение теплоты парообразования компенсируется в некоторой степени уменьшением величины ![]() . Ниже нормальной точки кипения (при
. Ниже нормальной точки кипения (при ![]() = 0,6-0,7) значение
= 0,6-0,7) значение ![]() очень близко к единице и изменение отношения
очень близко к единице и изменение отношения ![]() происходит исключительно вследствие изменения энтальпии.
происходит исключительно вследствие изменения энтальпии.
Информация о химии
Винклер (Winkler), Клеменс Александр
Немецкий химик Клеменс Александр Винклер родился во Фрейберге; его отец был химиком-металлургом. После окончания реального училища в Дрездене и ремесленной школы в Хемнице Винклер поступил во Фрейбергскую горную академию, которую ...
Крукс (Crookes), Уильям
Английский физик и химик Уильям Крукс родился в Лондоне 17 июня 1832 г. В 1848 –1850 гг. учился в Лондонском химическом колледже, после чего с 1850 по 1854 г. работал в колледже в качестве ассистента А.В.Гофмана. После непр ...
Берг (Berg), Пол
Американский биохимик Пол Берг родился в Нью-Йорке, в Бруклине. Он был одним из трех сыновей Гарри Берга и Сары (Бродски) Берг. Окончив в 1943 г. среднюю школу Авраама Линкольна, Берг поступил в Пенсильванский государственный колл ...


