Замещенные одноосновные ароматические кислоты
Рефераты по химии / Синтез нитробензойной кислоты / Замещенные одноосновные ароматические кислотыСтраница 1
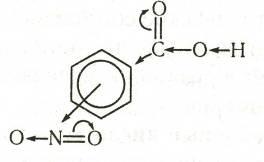
Нитробензойные кислоты
При нитровании бензойной кислоты получается 78%-мета-, 20% орто- и 2% пара-нитробензойных кислот. Два последних изомера без примесей других изомеров получают окислением орто- и пара- нитротолуолов.
Нитробензойные кислоты обладают более сильными кислотными свойствами, чем бензойная кислота (К = 6,6·10-5): о-изомер — в 100 раз, м-изомер — в 4,7 раза и п-изомер — в 5,6 раза. Аналогичная закономерность наблюдается и в случае галогенозамещенных кислот.
Константы ионизации замещенных бензойных кислот
|
Заместитель |
Положение | ||
|
орто- |
мета- |
пара- | |
|
CH3 |
1.2·10-4 |
5.3·10-5 |
4.2·10-5 |
|
OH |
1.1·10-3 |
8.3·10-5 |
3.3·10-5 |
|
OCH3 |
8.0·10-5 |
8.2·10-5 |
3.4·10-5 |
|
Br |
1.4·10-3 |
1.5·10-4 |
1.0·10-4 |
|
Cl |
1.2·10-3 |
1.5·10-4 |
1.0·10-4 |
|
NO2 |
6.7·10-3 |
3.1·10-4 |
3.7·10-4 |
Увеличение силы кислот с электроноакцепторными заместителями в п- и м-положении объясняется увеличением подвижности кислотного протона благодаря ослаблению связи О—Н (уменьшение электронной плотности)
Уравнение Гаммета было впервые использовано при изучении диссоциации м- и п-замещенных бензойных кислот. Для этой реакционной серии значение р было приняторавным 1 и, следовательно, уравнение Гаммета имело вид lgК/К0= ρ
σгде К — константа скорости или константа равновесия для замещенного соединения; К0 — аналогичная константа для незамещенного соединения; σ
— константа, характеризующая полярное влияние заместителя; ρ
— константа, определяющая степень чувствительности реакционного центра к полярным эффектам. Константа σзависит только от природы заместителя, а константа ρ
— от характера реакции.
Соединения с различными заместителями, но с одним и тем же реакционным центром образуют реакционную серию.
σ
-Константы некоторых заместителей приведены в таблице:
|
Заместитель |
σ |
Заместитель |
σ | ||
|
Мета- |
Пара- |
Мета- |
Пара- | ||
|
-H |
0 |
0 |
-I |
0.352 |
0.18 |
|
-CH3 |
-0.069 |
-0.17 |
-OH |
0.127 |
-0.37 |
|
-C2H5 |
-0.07 |
-0.151 |
-O |
-0.708 |
-0.519 |
|
-C(CH3)3 |
-0.1 |
-0.197 |
-OCH3 |
0.115 |
-0.268 |
|
-CF3 |
0.43 |
0.54 |
-NH2 |
-0.16 |
-0.66 |
|
-COOH |
0.355 |
0.265 |
-NHCOCH3 |
0.21 |
0 |
|
-COO- |
-0.1 |
0 |
-N(CH3)2 |
-0.211 |
-0.83 |
|
-COOC2H5 |
0.37 |
0.45 |
-N(CH3)3 |
0.88 |
0.82 |
|
-C0CH3 |
0.376 |
0.502 |
-NO2 |
0.71 |
0.778 |
|
-F |
0.337 |
0.062 |
-SO2 |
0.05 |
0.09 |
|
-CI |
0.373 |
0.227 |
-SO2NH2 |
0.46 |
0.57 |
|
-Br |
0.391 |
0.232 | |||
Информация о химии
Общая химия
О́бщая хи́мия — курс химии в ВУЗах, представляющий собой совокупность ряда разделов неорганической, органической, физической, аналитической химии, а также др. направлений химической науки. Основами современного кур ...
Создан материал с рекордной фосфоресценцией
Всего через минуту пребывания на солнце новый состав целых две недели довольно ощутимо светится в ближнем инфракрасном диапазоне. Фосфоресцентные материалы, выдающие видимое излучение после «накачки» светом, широко ра ...
Штреккер (Strecker), Адольф Фридрих Людвиг
Немецкий химик-органик Адольф Фридрих Людвиг Штреккер родился в Дармштадте; в 1842 г. окончил Гисенский университет, где одним из преподавателей у него был Ю. Либих. Был учителем в гимназии Дармштадта; в 1846 г. стал ассистентом Л ...


