Рабочий пример. Микросостояния атома углерода.
Рефераты по химии / Состояния и уровни многоэлектронных атомов. Орбитали и термы. Векторная модель / Рабочий пример. Микросостояния атома углерода.Страница 3
Удобство этой таблицы состоит в том, что она позволяет видеть в деталях схему распределения микросостояний по квантовым числам. При соблюдении несложных правил возникает возможность построить коллективные волновые функции ., но для качественного анализа такая детализация не нужна
36.1. Произведём из таблицы выборку микросостояний и сгруппируем их в двумерные массивы, рассматривая суммарные квантовые числа ML и MS так, чтобы они с шагом 1 независимо пробегали весь полный набор численных значений между максимальным и минимальным значениями. Получаются завершённые массивы, которые характеризуются едиными суммарными числами L и S. Связи и правила, регламентирующие отношения между суммарными квантовыми числами L и S и их проекциями ML и MS, точно такие же, как и у обычных одноэлектронных орбитальных и спиновых моментов. Эти связи определены общей теорией момента импульса и не зависят от его происхождения.
Каждое микросостояние отметим парой квантовых чисел - символом (ML
, MS
).
Обращаясь к предыдущей таблице, группируем микросостояния в 3 массива:
| |||||||||||||||||||||||||||||
Первый массив получается одномерным: L
=2; S
=0. В нём ML = -2; -1; 0; +1 +2 и MS =0.
Второй массив уже двумерный: L
=1; S
=1. В нём ML = -1; 0; +1 и MS = -1; 0; +1.
Третий массив вновь одномерный: L
=0; S
=0. В нём ML=0 и MS =0.
Перечисление всех проекций орбитального момента ML удобно заменить одним квантовым числом L - символом модуля суммарного орбитального момента.
Также перечисление проекций спинового момента ML удобно заменить одним квантовым числом S - символом модуля суммарного спинового момента.
17. В каждый такой массив попадают микросостояния одного уровня.
Общий уровень называется терм
. Каждая терм характеризуется двумя суммарными квантовыми числами L
и S
. Кратность вырождения терма
определяется числом принадлежащих ему микросостояний и равна произведению (2L
+1)´(2S
+1).
Это L-S
-термы или термы Рассел-Саундерса.
Номенклатура термов
в первую очередь учитывает эти два признака:
во-первых, величину орбитального момента импульса.
во-вторых, величину спинового момента импульса.
По величине суммарного
L
термы называются:
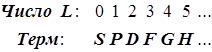
По величине суммарного спина
S вводится мультиплетность, равная 2S+1, и термы
получают дополнительное наименование – символ мультиплетности:
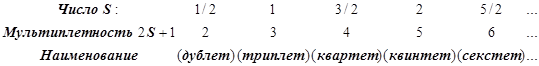
Результирующий символ атомного терма Рассел-Саундерса имеет вид ![]()
Резюме:
По этим признакам конфигурация ![]() порождает 15 микросостояний электронной оболочки, и они группируются в три терма:
порождает 15 микросостояний электронной оболочки, и они группируются в три терма:
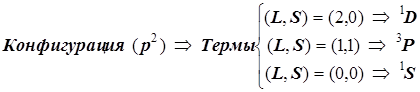
18. Следующая поправка к энергии оболочки атома имеет релятивистское происхождение и непосредственно не связана с кулоновским эффектами. Она называется спин-орбитальным эффектом. Название «спин-орбитальное взаимодействие» устоявшееся, но физически не вполне точное. Это просто привычный термин . .
Информация о химии
Вилланова (de Villanova), Арнальдо де
Испанский врач и алхимик Арнальдо де Вилланова (иначе – Арнольд из Виллановы) родился в Валенсии; происходил из простой семьи. Воспитывался в одном из доминиканских монастырей; в молодости много путешествовал по Европе. В Па ...
U — Уран
УРАН (лат. Uranium), U, химический элемент III группы периодической системы Менделеева, атомный номер 92, атомная масса 238,0289, относится к актиноидам. Свойства: радиоактивен, наиболее устойчивый изотоп 238U (период полураспада ...
Ti — Титан
ТИТАН (лат. Тitanium), Ti, химический элемент IV группы периодической системы, атомный номер 22, атомная масса 47,88. Свойства: серебристо-белый металл; легкий, тугоплавкий, прочный, пластичный; плотность 4,505 г/см3, tпл 1671 &d ...


