Физико-химические свойства водных растворов азотной кислоты
Рефераты по химии / Физико-химические свойства водных растворов азотной кислоты / Физико-химические свойства водных растворов азотной кислотыСтраница 3
где Q - теплота растворения HN03 в воде, кал/моль;
m - число молей HN03 подлежащих растворению в воде, г/моль;
n - число молей Н20, приходящих на 1 г/моль HN03, г/моль.
Изменение теплоемкости водных растворов азотной кислоты в зависимости от концентрации HN03 показано на рис. 8 [15], из которого видно, что при повышении температуры и снижении содержания HNO3 в растворе происходит закономерное увеличение теплоемкости.
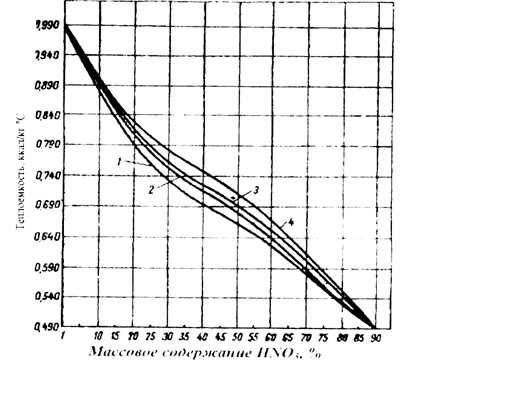
Рис. 8 - Зависимость теплоемкости от массового содержания азотной кислоты в системе HN03 – Н20 при различных температурах (°С): 1-2,53; 2-21,07; 3-39,49:4-61,11.
На рис. 9 представлена зависимость удельной электропроводности водных растворов азотной кислоты от массового содержания HN03 и температуры [16,17]. Максимальной электропроводностью обладают водные растворы азотной кислоты, содержащие 30-42% HN03. За пределами этих концентраций электропроводность растворов уменьшается. Закономерным является повышение электропроводности растворов HN03 - Н20 в зависимости от роста температуры.
Из табл. 3 видно, что повышение концентрации HN03 и снижение температуры приводит к увеличению плотности водных растворов азотной кислоты [2, 13].
Таблица 3 - Влияние концентрации HN03 и температуры на плотность (кг/м3) водных растворов азотной кислоты
|
Массовая концентрация HNO3 % |
Температура, |
°С | |||||||||||||||
|
5 |
10 |
20 |
30 |
40 |
60 |
80 |
100 | ||||||||||
|
5 |
1029,0 |
1028,2 |
1025,6 |
1022,2 |
1018,2 |
1008,4 |
996,5 |
892,9 | |||||||||
|
10 |
1059,4 |
1057,8 |
1054,3 |
1053,3 |
1045,5 |
1034,7 |
1022,1 |
1008,3 | |||||||||
|
20 |
1123,4 |
1120,6 |
115,0 |
1109,4 |
1103,1 |
1089,9 |
1075,4 |
1059,8 | |||||||||
|
30 |
1191,7 |
1187,6 |
1180,0 |
1172,7 |
1164,5 |
1148,2 |
1130,7 |
1112,2 | |||||||||
|
40 |
1261,3 |
1256,0 |
1246,3 |
1237,0 |
1227,0 |
1206,9 |
1185,8 |
1163,8 | |||||||||
|
50 |
1327,7 |
1321,5 |
1310,0 |
1298,7 |
1286,7 |
1262,8 |
1237,7 |
1211,8 | |||||||||
|
60 |
1386,8 |
1380,1 |
1366,7 |
1353,3 |
1339,8 |
1312,4 |
1283,9 |
1254,7 | |||||||||
|
65 |
1412,8 |
1405,5 |
1391,3 |
1377,0 |
1363,0 |
- |
- |
- | |||||||||
|
70 |
1436,2 |
1428,5 |
1413,4 |
1398,3 |
1383,7 |
- |
- |
- | |||||||||
|
75 |
1457,3 |
1449,4 |
1433,7 |
1418,0 |
- |
- |
- |
- | |||||||||
|
80 |
1476,4 |
1468,3 |
1452,1 |
1435,7 |
- |
- |
- |
- | |||||||||
|
85 |
1493,6 |
1485,2 |
1468,6 |
1451,8 |
- |
- |
- |
- | |||||||||
|
90 |
1508,5 |
1499,7 |
1482,6 |
1465,6 |
- |
- |
- |
- | |||||||||
|
95 |
1519,8 |
1510,9 |
1443,2 |
1476,1 |
- |
- |
- |
- | |||||||||
|
100 |
15,37 |
1529,3 |
1512,6 |
1494,8 |
- |
- |
- |
- | |||||||||
Информация о химии
Гераклит Эфесский
Древнегреческий философ-материалист Гераклит Эфесский родился и жил в малоазийском городе Эфесе. Он принадлежал к роду басилевсов, однако добровольно отказался от привилегий, связанных с происхождением, в пользу своего брата. Диог ...
Молекулы, защищающие мозг от нервнопаралитических газов
Новое семейство производных оксимов может проходить через гематоэнцефалический барьер мышей и защищать животных от отравления нервнопаралитическими газами. Исследователи, получившие эти оксимы, предполагают, что эти соединения мог ...
Эпикур
Древнегреческий философ-материалист Эпикур родился на острове Самос, в семье школьного учителя Неокла, выходца из Афин. В возрасте 32 лет он основал свою философскую школу, которая первоначально находилась в Митилене (на острове Л ...


