Интерполиэлектролитные комплексы
Рефераты по химии / Интерполиэлектролитные комплексыСтраница 12
ЗАКЛЮЧЕНИЕ
1) Методами рН-метрического титрования и вискозиметрии обнаружили и доказали комплексообразование в системе поливинилпирролидон-Са2+.
2) Изучили влияние температуры на стабильность образовавшегося комплекса. Увеличение вязкости полимера с повышением температуры - это плюс, так как при возможном использовании этого комплекса может потребоваться выделение его в твердом виде (для облегчения процесса изготовления таблеток либо для использования его возможных каталитических свойств). Однако в то же время можно сказать, что происходят деструктивные процессы. Было выяснено, что данный комплекс легко образуется при комнатной температуре, а также при каких угодно малых количествах металла.
СПИСОК ЛИТЕРАТУРЫ
1. А.А. Берлин, В.Е.Басян. «Основы адгезии полимеров», «Химия». М., 1969г.
2. Я.О.Бикерман. «Высокомолекулярные соединения», «Химия», 1968г.
3. Е.А. Бектуров, Л.А. Бимендина «Интерполимерные комплексы», «Наука Каз. ССР», А.-Ата, 1977г.
4. . Е.А.Бектуров, Л.А.Бимендина, Г.К.Мамытбеков. «Комплексы водорастворимых полимеров и гидрогелей», А.-Ата, 2002г.
5. Л.А. Бимендина, М.Г. Яшкарова, С.Е. Кудайбергенов, Е.А. Бектуров. «Полимерные комплексы», Семипалатинск, 2003г.
6. С.С. Воюцкий. «Адгезия и аутогезия полимеров», «Ростехиздат», М., 1963г.
7. А.Г.Гавриленко, К.С.Тусупова, С.В.Тарасенко. «Оформление курсовых и дипломных работ естественно-научных специальностей», Государственный университет имени Шакарима, Семипалатинск, 2000г.
8. Б.А.Киселев. «Стеклопластики», «Госхимиздат», M., 1961г.
9. В.А. Кабанов «Физико-химические основы и перспективы применения растворимых интерполиэлектролитных комплексов», М., 1994г.
10. В.А. Кабанов, А.Б. Зезин. «Водорастворимые нестехиометричные полиэлектролитные комплексы – новый класс синтетических полиэлектролитов», Сер. «Органическая химия». М., 1984г.
11. Н. А.Кротова. «О склеивании и прилипании», Изд-во АН СССР. М., 1960г.
12. И.К.Цитович. «Курс аналитической химии», М., «Высшая школа», 1985г.
ПРИЛОЖЕНИЕ А.
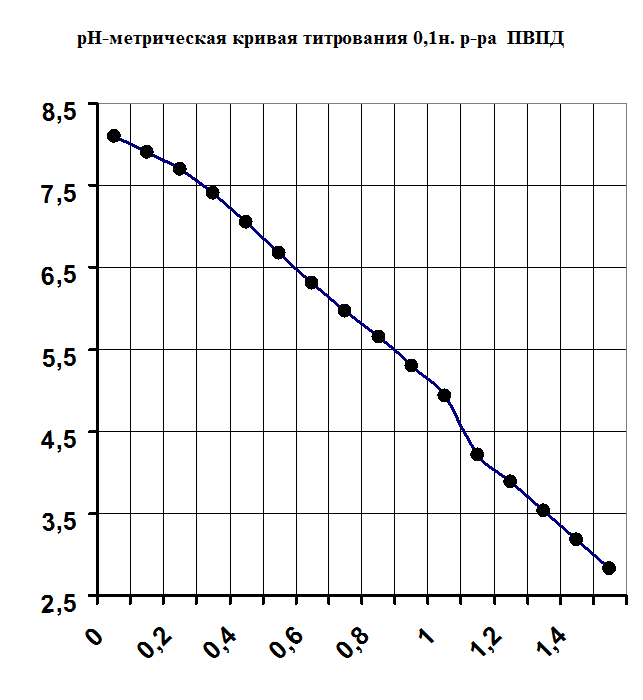 Рисунок №1.
Рисунок №1.
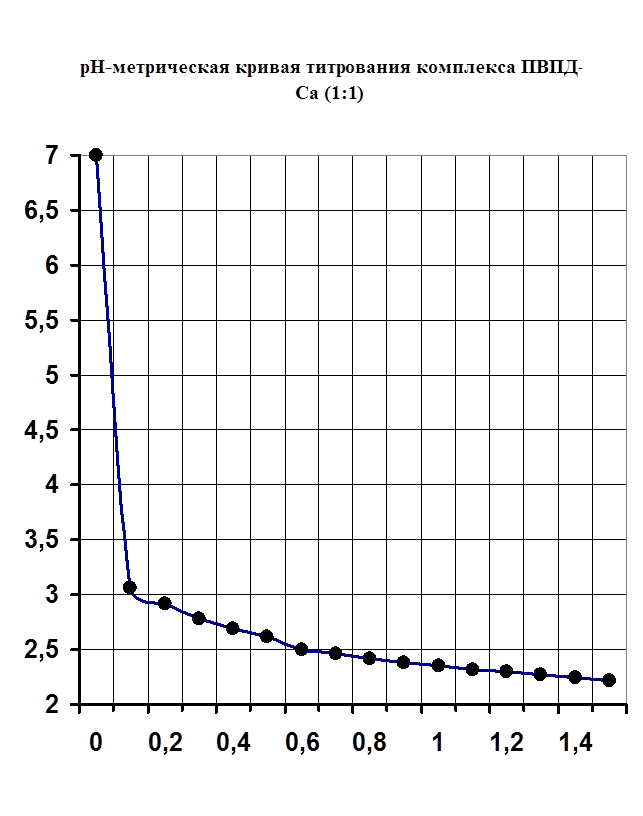
Рисунок №2.
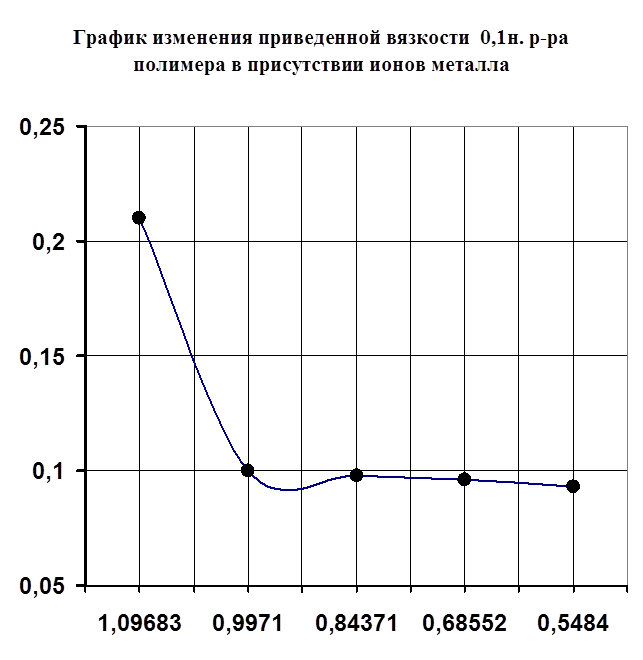
Рисунок №3.
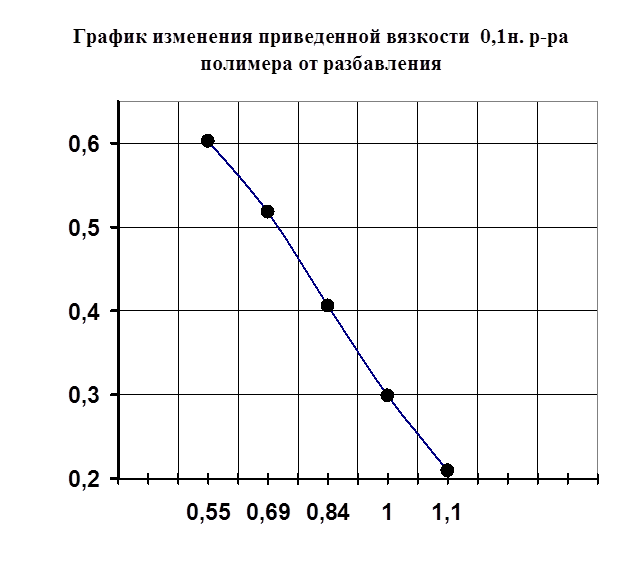
Рисунок №4.
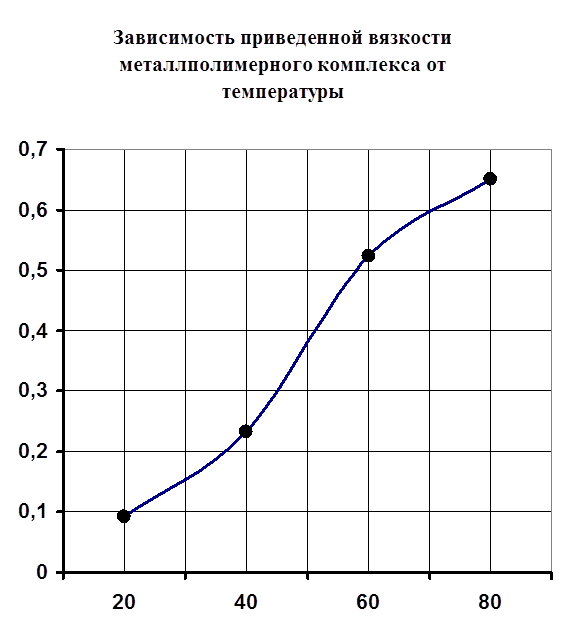
Рисунок №5.
Приложение
Б
Результаты потенциометрического титрования системы ПВПД-Ca2+ 1н. р-ром HCl.
|
Количество прилитого 1н. HCl, мл. |
Значения рН первого титрования |
Значения рН второго титрования |
Значения рН третьего титрования |
Среднее значение рН |
|
0 |
7,0 |
7,0 |
7,0 |
7,0 |
|
0,1 |
3,0 |
3,2 |
3,0 |
3,06 |
|
0,2 |
2,8 |
3,05 |
2,9 |
2,92 |
|
0,3 |
2,71 |
2,9 |
2,74 |
2,78 |
|
0,4 |
2,62 |
2,8 |
2,65 |
2,69 |
|
0,5 |
2,6 |
2,7 |
2,57 |
2,62 |
|
0,6 |
2,55 |
2,47 |
2,49 |
2,5 |
|
0,7 |
2,52 |
2,45 |
2,43 |
2,46 |
|
0,8 |
2,48 |
2,4 |
2,38 |
2,42 |
|
0,9 |
2,45 |
2,35 |
2,35 |
2,38 |
|
1,0 |
2,42 |
2,32 |
2,33 |
2,35 |
|
1,1 |
2,38 |
2,29 |
2,3 |
2,32 |
|
1,2 |
2,35 |
2,27 |
2,28 |
2,3 |
|
1,3 |
2,31 |
2,24 |
2,26 |
2,27 |
|
1,4 |
2,28 |
2,23 |
2,25 |
2,25 |
|
1,5 |
2,25 |
2,2 |
2,21 |
2,22 |
Информация о химии
Водорода пероксид
Синонимы: водорода перекись Внешний вид: бесцветн. жидкость Брутто-формула (система Хилла): H2O2 Молекулярная масса (в а.е.м.): 34,01 Температура плавления (в °C): -0,43 Температура кипения (в °C): 152 Растворимость ...
Вилланова (de Villanova), Арнальдо де
Испанский врач и алхимик Арнальдо де Вилланова (иначе – Арнольд из Виллановы) родился в Валенсии; происходил из простой семьи. Воспитывался в одном из доминиканских монастырей; в молодости много путешествовал по Европе. В Па ...
Bi — Висмут
ВИСМУТ (лат. Bismuthum), Bi (читается «висмут», до середины 20 века произносили «бисмут»), химический элемент V группы периодической системы, атомный номер 83, атомная масса 208,9804. Серебристо-серый мета ...


