Получение гексанитрокобальтата натрия
Рефераты по химии / Получение гексанитрокобальтата натрияСтраница 3
Во внутренней сфере между комплексообразователем и лигандами формируются полярные ковалентные связи. Частицы внешней сферы удерживаются около комплекса за счет электростатического ионного взаимодействия, т.е. характер связи - преимущественно ионный.
Для объяснения химической связи в комплексных соединениях используют: метод валентных связей (ВС),теорию кристаллического поля. Арочные и круглые окна купить - купить деревянное арочное окно woodcortspb.ru.
Рассмотрим метод ВС. Химическую связь в комплексе, т.е. между комплексообразователем и лигандами обычно объясняют с позиций донорно-акцепторного механизма. При этом, как правило, лиганды предоставляют неподеленные электронные пары, а комплексообразователи - свободные орбитали.
3d 4s 4p 4d

Для комплексных соединений, так же как и для органических веществ, характерна изомерия. Изучение изомерии комплексов позволило установить их пространственное строение. Нитрит – ион как лиганд может координироваться через атом азота, образуя нитро-комплексы, или через атом кислорода, образуя нитрито-комплексы. Такая изомерия известна для комплексов многих переходных металлов (Co3+, Rh3+, Ir3+, Pt4+).
Например, в реакциях образования комплексов Co3+ с нитрит-ионами вначале получаются нитрито-комплексы, имеющие розовую окраску которые со временем переходят в устойчивые желто-коричневые нитро-комплексы. Следует отметить, что являясь лигандом сильного поля, нитрит-ион стабилизирует в комплексах высокие степени окисления 3d-металлов. Например, Co3+ в Nа3[Со(NО2)6].
Так для иона [Co(NO2)6]3- структура комплекса – октаэдрическая (рис 1).
Рис 1. 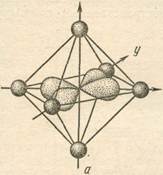
По характеру распределения электронов по орбиталям Co3+ ион [Co(NO2)6]3- является низкоспиновым ионом (имеются неспаренные электроны). Комплекс Na3[Co(NO2)6] диамагнитный, низкоспиновый, внутриорбитальный, октаэдрический.
1.2 Физические и химические свойства данного вещества (электролитическая диссоциация, устойчивость и способы разрушения комплексного соединения, участие в обменных реакциях)
Na3[Co(NO2)6] – тонкий порошок желтого цвета, в безводном состоянии не выделен. При слабом нагревании разлагается. Хорошо растворяется в холодной воде. Водные растворы соли неустойчивы. Не реагирует с гидратом аммиака. Разлагается в кипящей воде, сильных кислотах и концентрированных щелочах. Устойчив на воздухе. Нерастворим в спирте и эфире. Устойчивое соединение. Плотность 2, 64 г/ см3[2].
Химические свойства Na3[Co(NO2)6]:
1)Разложение Na3[Co(NO2)6] при температуре200-250 С:
4 Na3[Co(NO2)6] 0,5H2O=12NaNO2+CoO+4NO+8NO2+2H2O
2)Взаимодействие с холодной водой:
Na3[Co(NO2)6]+12H2O(хол)=3[Na(H2O)4]++ [Co(NO2)6]3-
3)Взаимодействие с горячей водой:
3Na3[Co(NO2)6]+ 2H2O(кип)=9NaNO2+3CoNO3(OH) +5NO +HNO3
4)Реакции с разбавленными кислотами:
3Na3[Co(NO2)6]+2HNO3(разб)=9NaNO2+3Сo(NO3)2+5NO+H2O
5)Характерны реакции с концентрированными щелочами:
Na3[Co(NO2)6]+2NaOH(конц)=Co(OH)2 +4 NaNO2+NaNO3+NO
6)Взаимодействие с солями K+,Cs+,Tl+,Ag+,NH4+:
Na3[Co(NO2)6]+3MeNO3=Me3[Co(NO2)6] +3 NaNO3 [2]
Электролитическая диссоциация.
Диссоциация по 1 ступени:
![]() Na3[Co(NO2)6] 3Na++[Co(NO2)6]3-
Na3[Co(NO2)6] 3Na++[Co(NO2)6]3-
Диссоциация иона протекает по 6 ступеням:
![]() [Co(NO2)6]3- Co3++6NO2-
[Co(NO2)6]3- Co3++6NO2-
= [Co(NO2)6]3-/[Co3+] [NO2-]6
1.3
Методы получения и очистки
1 способ.
Комплексы Co3+ обычно получают окислением соединений Co2+ в присутствии соответствующего лиганда.
Co(NO3)2 + 7 NaNO2 + 2 CH3COOH= Na3[Co(NO2)6] + 2 NaNO3 + 2 Na(CH3COO) + NO + H2O
РАБОТАТЬ ПОД ТЯГОЙ! В стакане емкостью 100 мл. при осторожном нагревании растворяют 7 г. NaNO2 в 7 мл. H2O. В раствор вносят 2,5 г. кристаллического Co(NO3)2 6H2O и из капельной воронки приливают 2,5 мл. 50% CH3COOH. Смесь в стакане перемешивают встряхиванием. После внедрения кислоты раствор перемешивают еще 10 минут. Если навеска была загрязнена KNO2, то при окислении раствора осаждается K2Na[Co(NO2)6], в этом случае раствор по окончании окисления следует отфильтровывать. К полученному раствору приливают при перемешивании 17 мл. C2H5OH. Раствор с выпавшим осадком оставляют на 1 час для окончательной кристаллизации. Осадок отфильтровывают на воронке Бюхнера, промывают небольшим количеством спирта, сушат на воздухе на листе фильтровальной бумаги, перемешивая стеклянной палочкой, и взвешивают. Рассчитывают выход продукта [3].
Информация о химии
Термохимия
Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из зад ...
Бартон (Barton), Дерек Харолд Ричард
Английский химик Дерек Харолд Ричард Бартон родился в Грейвзенде, на берегу Темзы, неподалеку от Лондона, в семье Уильямса Томаса Бартона и Мод (Хенриетты) Бартон. Получив начальное и среднее образование в тонбриджской школе, он с ...
Ac — Актиний
АКТИНИЙ (лат. Actinium), Ac, химический элемент III группы периодической системы, атомный номер 89, атомная масса 227,0278. Свойства: радиоактивен, наиболее устойчивый изотоп 227Ac (период полураспада 21,8 года). Серебристо-белый ...


