Получение коллоидных растворов
Рефераты по химии / Получение коллоидных растворовСтраница 4
CuSO4 + 4NH3 ® [Cu(NH3)4] SO4 --- сульфат тетраамминмеди (II).
В три пробирки с раствором перекиси водорода (по 1 мл) добавляют: в первую – 0,2 мл раствора CuSO4, во вторую – несколько капель раствора [Cu(NH3)4] SO4, в третью – 0,2 мл «раствора» каталазы. Наблюдают разную каталитическую активность веществ, используемых в качестве катализаторов.
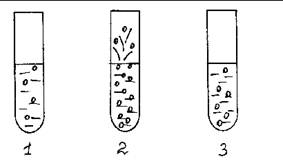
Рис. 6. Каталитическое разложение H2O2.
Техника безопасности. Не допускать попадания раствора перекиси водорода на кожу и одежду. Осторожно добавлять аммиакат меди к перекиси водорода. Реакция идет бурно.
Утилизация. Все растворы в пробирках перенести в емкость–нейтрализатор.
Опыт № 3. Экзотермические реакции
Оборудование и реактивы: Пробирка или железная банка, сульфат меди (кристал.), железный порошок, вода, стеклянная палочка.
Ход работы: В пробирку или железную банку внести хорошо перемешенные сульфат меди и железный порошок в соотношении количества вещества 1:1. Смесь смочить водой до кашицеобразного состояния и перемешать стеклянной палочкой. Пробирка сильно нагревается за счет тепла экзотермической реакции: CuSO4 + Fe ® FeSO4 + Cu.
Утилизация. Растворить смесь в воде. Отфильтровать. Осадок металлического железа с медью высушить, поместить в сухую склянку и герметично закрыть пробкой. Смесью металлов можно воспользоваться для демонстрации коррозии контакта Fe–Cu в нейтральной или слабокислой среде.
Для этого: а) Немного смеси внести в пробирку с водой на 1 – 2 суток. Появляются бурые продукты коррозии:
А- ô Fe0 – 2 ē® Fe2+;
К+ ôСuô 2H2O + 4ē + O2 ® 4 OH-
Далее: Fe2+ + 2OH- ® Fe(OH)↓2; 4 Fe(OH)2↓ + O2 + 2H2O ® 4Fe(OH)↓3.
б) Немного смеси внести в очень слабый раствор соляной кислоты. Через некоторое время также образуется бурый осадок:
А- ô Fe0 – 2 ē® Fe2+; К+ ôCuô 2H+ + 2ē ® H2;
Далее: Fe2+ + 2Cl- ® FeCl2; 4FeCl2 + O2 + 2H2O ® 4FeOHCl2;
FeOHCl2 + 2H2O ® Fe(OH)3↓ + 2HCl.
После демонстрации опытов по коррозии слить все в раковину. В фильтрат, содержащий растворы CuSO4 и FeSO4, (см. выше) внести железный предмет, например, хорошо очищенный гвоздь. Далее утилизацию проводят по схеме, описанной в работе № 2, опыт № 5, VIII класс.
Опыт № 4. Смещение химического равновесия гидролиза
NaHCO3
Оборудование и реактивы: Гидрокарбонат натрия, химический стакан, вода, электрическая плитка, ложечка для сжигания.
Ход работы: В кипящую воду в химическом стакане прибавляют ложечку кристаллического гидрокарбоната натрия. Происходят следующие процессы:
NaHCO3 ® Na+ + HCO-3 – диссоциация
HCO-3 + HOH ® H2CO3 + OH- - гидролиз аниона HCO-3
NaHCO3 + HOH ® NaOH + CO2 + H2O.
Повышение температуры оказывает влияние на смещение химического равновесия гидролиза в сторону образования продуктов реакции CO2 и H2O. Бурное выделение газа свидетельствует о полном смещении химического равновесия гидролиза NaHCO3. Объясните, почему повышение температуры смещает равновесие гидролиза вправо?
Утилизация. Содержимое стакана со щелочным раствором перенести в емкость–нейтрализатор.
Информация о химии
Рихтер (Richter), Иеремия Вениамин
Немецкий химик Иеремия Вениамин Рихтер родился в Хиршберге, в Силезии. В молодости семь лет он служил в корпусе военных инженеров, а с 1785 г. изучал математические и философские науки в Кенигсбергском университете, где слушал лек ...
Нефтехимия
Понятие нефтехимии охватывает несколько взаимосвязанных значений: раздел химии, изучающий химизм превращений углеводородов нефти и природного газа в полезные продукты и сырьевые материалы; раздел химической технологии (второе на ...
Усилитель поможет алмазу следить за атомами
Исследователи из Оксфорда и Сингапурского университета заявляют, что молекула-«усилитель», размещенная на острие алмаза, может оказаться полезной в обнаружении и идентификации отдельных атомов. Новая идея основана на ...


