Получение коллоидных растворов
Рефераты по химии / Получение коллоидных растворовСтраница 3
Опыт № 6. Эндотермические реакции
Оборудование и реактивы: Прибор для электролиза, две пробирки, два кристаллизатора, раствор NaOH (массовой долей 5-8 %), изогнутые газоотводные трубки, железные электроды.
Ход работы: Примером эндотермической реакции может стать разложение воды электрическим током. Собирают установку согласно рис. 5. U-образную трубку заполнить на 2/3 объема раствором NaOH, закрыть отверстия трубки пробками с железными электродами.
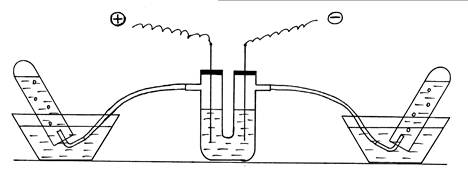
Рис. 5. Демонстрация эндотермической реакции разложения воды.
Две пробирки наполняют дистиллированной водой и опрокидывают вверх дном в кристаллизаторы с водой. В пробирки подводят изогнутые газоотводные трубки от электролизера. Прибор подключают к источнику тока. Наблюдают образование и накопление газов в пробирках (следует обратить внимание на соотношение их объемов). Отключить внешний источник энергии, реакция разложения заканчивается без подвода внешней энергии. Написать уравнение электролиза раствора NaOH.
Утилизация. Раствор щелочи в U-образной трубке использовать повторно, добавив более концентрированный раствор NaOH (контроль по показаниям ареометра).
ЛАБОРАТОРНАЯ РАБОТА № 2
Опыт № 1. Получение комплексных соединений
Оборудование и реактивы: Пробирки, разбавленные растворы: AlCl3, NaOH, AgNO3, NH4OH, NaCl, CuSO4, раствор NaCl насыщенный, NH4OH (конц.).
Ход работы: Провести химические процессы согласно уравнениям реакций:
1). AlCl3 + 3NaOH ® Al(OH)3↓ + 3NaCl --- добавляют раствор щелочи в недостатке.
Al(OH)3↓ + NaOH ® Na[Al(OH)4] --- добавляют раствор щелочи в небольшом избытке.
2). AgNO3 + NH4OH ® NH4NO3 + AgOH↓ --- добавляют в недостатке разбавленный раствор гидроксида аммония.
2AgOH↓® Ag2O + H2O --- наблюдают частичное самопроизвольное разложение AgOH, смесь темнеет.
Ag2O + 4NH4OH ®2[Ag(NH3)2]OH + 3H2O -- добавляют избыток концентрированного раствора гидроксида аммония. Получили «аммиачный раствор оксида серебра».
3). AgNO3 + NaCI ® AgCl↓ + NaNO3 -- используют предельно разбавленные растворы исходных веществ. Хлорид серебра должен получиться в виде суспензии, а не творожистого осадка. К небольшой части этой суспензии (0,5–1 мл) добавить избыток насыщенного раствора хлорида натрия. Наблюдают растворение осадка:
AgCl↓ + NaCl ® Na[AgCl2 ]
Последняя реакция может проводиться на кафельной пластине.
4). CuSO4 + 2NH4OH ® Cu(OH)2↓ + (NH4)2SO4 --- добавляют недостаток разбавленного раствора гидроксида аммония.
Cu(OH)2↓ + 4NH3 ® [Cu(NH3)4](OH)2 – гидроксид тетраамминмеди (II); (добавляют избыток концентрированного раствора аммиака).
Или: CuSO4 + 4NH3 ® [Cu(NH3)4] SO4 --- сульфат тетраамминмеди (II) синего цвета.
Утилизация. Полученный аммиакат меди оставить для демонстрации опыта “Разложение перекиси водорода” в качестве катализатора. Избыток аммиаката меди, накопленный в лаборатории, слить в стакан, добавить малыми порциями раствор серной кислоты массовой долей 5-10% (Осторожно! Сильное разогревание!). Происходит разрушение аммиаката, раствор приобретает голубую окраску сульфата меди. Полученную смесь сульфата меди и сульфата аммония можно использовать вновь для демонстрации получения аммиаката меди. Для этого следует добавить в емкость раствор щелочи. После нейтрализации раствора кислоты, система приобретает вновь синее окрашивание.
В пробирку с тетрагидроксоалюминатом натрия пропустить углекислый газ, выпадает осадок Al(OH)3: Na[Al(OH)4] + CO2 = Al(OH)3↓ + NaHCO3.
Осадок промыть и высушить. Аналогично утилизируют раствор Na2[Zn(OH)4] при получении комплексного соединения из гидроксида цинка: Na2[Zn(OH)4] + 2CO2 = Zn(OH)2↓ + 2NaHCO3.
Комплексное соединение серебра – аммиачный раствор оксида серебра в дальнейшем использовать в качестве реактива для обнаружения альдегидов. Дихлороаргентат натрия поместить в склянку для сбора серебросодержащих остатков.
Опыт № 2. Каталитическое разложение пероксида водорода в присутствии ионов меди, аммиаката меди и каталазы
Оборудование и реактивы: Пробирки, раствор перекиси водорода (10%), раствор сульфата меди (5%), раствор аммиаката меди, раствор каталазы (мясная или картофельная вытяжка).
Ход работы: Для проведения опыта необходимо приготовить растворы каталазы и аммиаката меди. Для приготовления каталазы необходимо свежий мясной фарш залить водой, тщательно перемешать и отжать. Отжатую жидкость профильтровать, фильтрат использовать для опыта. Для приготовления аммиаката меди нужно к раствору сульфата меди (II) прилить избыток концентрированного раствора аммиака:
Информация о химии
Карно (Carnot), Никола Леонар Сади
Французский физик и военный инженер Никола Леонар Сади Карно, один из основателей термодинамики, родился в Париже в семье видного государственного деятеля наполеоновской эпохи Лазара Карно. Его отец, будучи генералом и политиком, ...
Аррениус (Arrhenius), Сванте Август
Шведский физикохимик Сванте Август Аррениус родился в имении Вейк, недалеко от Упсалы. Он был вторым сыном Каролины Кристины (Тунберг) и Сванте Густава Аррениуса, управляющего имением. Предки Аррениуса были фермерами. Через год по ...
Гейровский (Heyrovsky), Ярослав
Чехословацкий химик Ярослав Гейровский родился в Праге и был пятым из шести детей Леопольда Гейровского, профессора римского права Карлова университета в Праге, и Клары Гейровской (в девичестве Ганловой). Его отец был ревностным ч ...


