Получение молибдена из отходов промышленности
Рефераты по химии / Получение молибдена из отходов промышленностиСтраница 20
Из анализа себестоимости парамолибдата с учетом использования хвостов первичного выщелачивания следует, что более 90% себестоимости составляет стоимость сырья.
Для получения молибдена можно использовать также и растворение в азотной кислоте, но этот процесс имеет несколько отличительных черт. Для рентабельности азотнокислотного вскрытия необходимо, чтобы избыток азотной кислоты и продукты ее разложения могли быть регенерированы и эффективно использованы. В противном случае метод нерентабелен, так как вместо прямого использования кислорода воздуха, как это происходит при окислительном обжиге в печах, окисление производится дорогой азотной кислотой, предварительно полученной тоже из азота и кислорода воздуха. Нельзя допускать и выброса в атмосферу окислов азота, получающихся при разложении кислоты в ходе реакции. Схема азотнокислотного метода показана на рис. 4. Основная реакция взаимодействия M0S2 с HNO3:
MoS2 + 6HNO3 = Н2МоО4 + 2H2SO4 + 6N0
Реальный расход кислоты на окисление чистого MoS2 близок к теоретическому по этой реакции. Но при разложении концентрата кислота расходуется еще и на разложение примесных минералов, испарение, термическое разложение. Поэтому общий расход кислоты значительно выше расчетного (расчетный расход 3,16 т, в пересчете на 60%-ную кислоту, на окисление молибденита в 1 т концентрата, содержащего 48 – 50% Мо).
Некоторые возможные реакции взаимодействия примесных минералов с азотной кислотой: .
CaCO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2
Са3 (РО4)2 + 6HNO3 = 3Са (NO3)2 + 2Н3РО4
As2S3 + 12HNO3 = 2H3AsO4 + 3H2SO4 + 8NO + 4NO.
Молибденовая кислота первоначально оказывается полностью в растворе, а затем в значительной степени выпадает в осадок. В растворе молибден находится в основном в составе комплексных анионов [MoO(MoO4) (SO4)2]2-. В газовой фазе, помимо NО, находятся другие окислы азота и пары кислот. К концу разложения молибденита азотной кислотой в растворе содержится 15—25 г/л Мо. Растворимость Н2МоО4 в воде ~2 г/л при 20°.
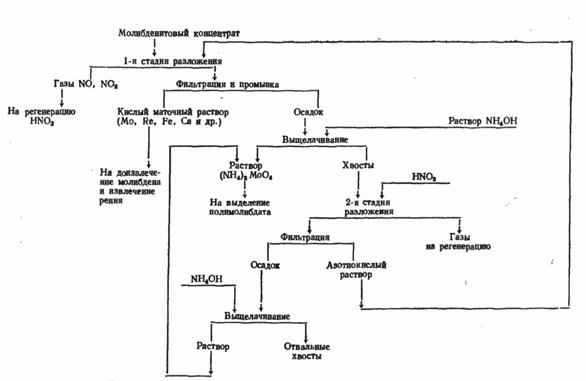
Рис. 4. Получение молибдена с использованием азотной кислоты
Из азотнокислых растворов молибден можно выделить в зависимости от избытка кислоты, содержания молибдена и примесей экстракцией или осаждением ферромолибдата.
Окисление MoS2 гипохлоритом в растворах. Молибденит окисляется гипохлоритом кальция по реакции.
MoS2 + 9СlО- + 6ОН- = МоО![]() + 2SO
+ 2SO![]() + 3Н2О + 9Сl-
+ 3Н2О + 9Сl-
Реакция протекает со значительным выделением свободной энергии: ΔZ298= - 343, 6 ккал. Преимущества процесса гипохлоритного окисления – это избирательность окисления молибдена и полнота извлечения его в раствор при низкой температуре. Практический расход в 1,5 – 2 раза выше теоретического. В заводской практике способ не применяется.
Oкисление молибденита кислородом в автоклавах [20]. Окисление может производиться в растворах КОН, NH4ОН, NaOH, Na2CO3. Принципиальная реакция окисления кислородом проходит по уравнению
Информация о химии
Берцелиус (Berzelius), Йёнс Якоб
Шведский химик Йёнс Якоб Берцелиус родился в селении Веверсунде на юге Швеции. Его отец был директором школы в Линчепинге. Берцелиус рано потерял родителей и уже во время обучения в гимназии зарабатывал частными уроками. Тем не ме ...
Штреккер (Strecker), Адольф Фридрих Людвиг
Немецкий химик-органик Адольф Фридрих Людвиг Штреккер родился в Дармштадте; в 1842 г. окончил Гисенский университет, где одним из преподавателей у него был Ю. Либих. Был учителем в гимназии Дармштадта; в 1846 г. стал ассистентом Л ...
Химия почв
Химия почв — это раздел почвоведения, изучающий химические основы почвообразования и плодородия почв. Основой для решения этих вопросов служит исследование состава, свойств почв и протекающих в почвах процессов на ионно-мол ...


