Производство кальцинированной соды
Рефераты по химии / Производство кальцинированной содыСтраница 7
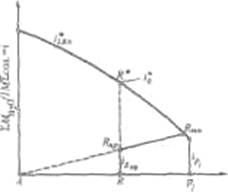
Рис.5 Сечение диаграммы по ARP1:
i*LBN – количество воды в равновесном растворе; iR.пр – количество воды в технологическом растворе; ip1 - количество воды в растворе Р1; R – фигуративная точка реакционной смеси.
Сущность процесса может быть выражена таким образом, что при обработке насыщенного аммиаком рассола углекислым газом сперва происходит как – бы нейтрализация этого раствора углекислотой, сопровождающаяся значительным выделением тепла, а в дальнейшем, по мере повышения в растворе концентрации средней углеаммониевой соли, начинается ее обменное разложение с поваренной солью с образованием соды, которая при дальнейшем действии на раствор углекислоты образует наименее растворимое соединение – бикарбонат.
С практической точки зрения является интересным не только ход реакции и достижение наилучшего выхода бикарбоната, но и качество (физические свойства, структура) получаемого осадка бикарбоната. В заводских условиях, когда выпадение бикарбоната начинается при несколько повышенной температуре, а рост кристаллов – при охлаждении, получается крупно - кристаллический, хорошо отстаивающийся, хорошо фильтрующийся и хорошо промывающийся осадок. Пределом охлаждения на заводах чаще всего является температура 28 – 30ºС, но иногда и ниже – до 25ºС. Структура осадка имеет большое значение, так как легкость и скорость фильтрации и промывки сокращает расход пара на дистилляцию маточных жидкостей, а, кроме того, уменьшает остающуюся в бикарбонате после фильтрации влажность, что в свою очередь облегчает кальцинацию осадка и сокращает расход топлива на этот процесс. Слишком сильное охлаждение вызывает образование очень мелкого, илообразного осадка, который трудно фильтруется и нарушает и удорожает нормальный ход производства.
Очистка рассола поваренной соли
На содовых заводах сырой рассол очищают от примесей известково – содовым способом. В этом случае для осаждения солей кальция используют соду, для осаждения солей магния – известковую суспензию.
В основе известково-содового способа лежат реакции ионного обмена, приводящие к образованию труднорастворимых карбоната кальция и гидроксида магния:
Ca2++CO32-↔CaCO3; Mg2++2OH-↔Mg(OH)2
Полнота выделения ионов магния и кальция в осадок, а следовательно, степень очистки, определяется растворимостью СаСО3 и Mg(OH)2 в растворе хлорида натрия. Косвенным параметром, характеризующим полноту выделения Са2+ и Mg2+ в осадок, может служить величина pH, что важно при создании автоматической системы управления процессом очистки.
Основными трудностями первой стадии очистки рассола являются низкая скорость сгущения суспензии гидроксида магния и неудовлетворительная скорость фильтрования сгущенной суспензии. Установлено, что в процессе осаждения происходит образование аморфного (или близкого к аморфному) продукта с довольно высокой растворимостью. Продолжительность его существования зависит от состава маточного раствора, температуры и свойств используемой щелочи. Такой продукт представляет собой гидратированный гидроксид магния: Mg(OH)2·(Н2О)m. Расстояние между плоскостями спайности у такого гидроксида больше длины молекул воды. Процесс созревания осадка, который может продолжаться несколько суток, можно описать уравнением
Mg(OH)2·(Н2О)m→ Mg(OH)2+mН2О; 1<m<2.
В результате образуется гидроксид магния с хорошими седимен-тационными свойствами, имеющий решетку типа брусита.
Необходимо отметить, что с повышением температуры рассола увеличиваются скорость отстоя и уплотнение суспензии. С другой стороны, повышение температуры нежелательно для последующей стадии производства — абсорбции аммиака. Поэтому на стадии рассолоочистки температуру рассола поддерживают не выше 22 °С (при большом содержании ионов магния).
На рис. 6 приведена технологическая схема очистки рассола известково-содовым способом. В бак 1 подают содовый раствор, для приготовления которого используются кальцинированная сода и очищенный рассол. Из гасительного отделения цеха известковых печей в бак 2 поступает известковая суспензия (90 ±10 н. д.). Для регулирования титра известковой суспензии в мешалку-резервуар 2 подводят очищенный рассол. Далее реагенты поступают в смеситель 3.
Технологическая схема отделения очистки
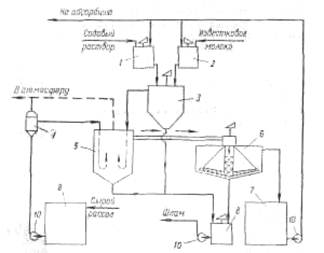 Рис. 6 Схема отделения очистки рассола: 1 – бак содового раствора; 2 - бак известкового молока; 3 – смеситель; 4 – расширитель; 5 – реактор; 6 – отстойник; 7 – резервуар очищенного рассола; 8 – сборник шлама; 9 – сборник неочищенного рассола; 10 – насосы.
Рис. 6 Схема отделения очистки рассола: 1 – бак содового раствора; 2 - бак известкового молока; 3 – смеситель; 4 – расширитель; 5 – реактор; 6 – отстойник; 7 – резервуар очищенного рассола; 8 – сборник шлама; 9 – сборник неочищенного рассола; 10 – насосы.
Информация о химии
Sr — Стронций
СТРОНЦИЙ (лат. Strontium), Sr, химический элемент II группы периодической системы, атомный номер 38, атомная масса 87,62, относится к щелочноземельным металлам. Свойства: серебристо-белый металл; плотность 2,63 г/см3, tпл 768 &de ...
Исследователи вскрыли молекулярные отличия кухонь мира
Учёные выявили, что блюда из Северной Америки, Западной Европы, Латинской Америки, Южной Европы и Восточной Азии обладают характерными «подписями», которые далеко не всегда очевидны, если смотреть просто на ингредиенты ...
At — Астат
АСТАТ (лат. Astatium), At, химический элемент VII группы периодической системы, атомный номер 85, атомная масса 209, 9871, относится к галогенам. Свойства: по одним свойствам напоминает неметалл иод, по другим металл полоний. Рад ...


