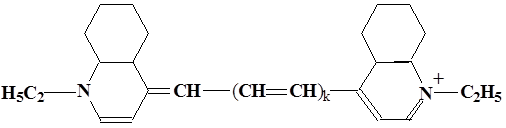Электронные спектры поглощения. Электронные спектры красителей и модель одномерного ящика.
Рефераты по химии / Молекулярные спектры / Электронные спектры поглощения. Электронные спектры
красителей и модель одномерного ящика.Страница 1
 Для химии наибольший интерес представляют спектральные переходы электронов между уровнями граничных орбиталей молекул (ВЗМО и НСМО).
Для химии наибольший интерес представляют спектральные переходы электронов между уровнями граничных орбиталей молекул (ВЗМО и НСМО).
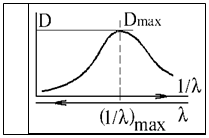
Наиболее лабильные внешние валентные электроны молекул переходят на близлежащий вакантный уровень. Электронные спектры молекул обычно регистрируют в виде широких полос с достаточно выраженным максимумом поглощения (рис. ).
Среди всех регистрируемых полос электронного спектра при переходе ВЗМО«НСМО частота, волновое число и энергия кванта минимальны, а длина волны максимальна. Реальные полосы часто не столь гладкие кривые из-за дополнительных переходов в молекуле .
Полезно рассмотреть задачу, в которой измеренные энергетические параметры электронных спектров удаётся количественно связать с уровнями граничных МО. Это классическая задача о максимумах полос поглощения в электронных спектрах карбоцианиновых красителей, решённая Бейлисом и Куном.
Примитивная модель одномерного потенциального ящика оказывается на удивление точной при описании энергий возбуждения ВЗМО«НСМО.
Задача 1
В гомологическом ряду, образованном четырьмя карбоцианиновыми красителями измерены максимумы полос электронных спектров поглощения. Формулы соединений и
измеренные величины следующие. Определите длину повторяющегося молекулярного фрагмента в гомологическом ряду полиенов.
|
Таблица.
Исходные данные, промежуточные вычисления и конечный результат
|
Измерено |
Вычисления студентов в ходе решения задачи | ||||
|
max |
max см-1 |
(9+2k)× max |
Значения 1/a 2 |
< aCH >, | |
|
k |
Экспер. |
см | |||
|
0 |
5900 |
16949.15 |
9×16949 = 152540 |
5.0325×1015 | |
|
1 |
7100 |
14084.50 |
11×14084 = 154924 |
5.1117×1015 | |
|
2 |
8200 |
12195.12 |
13×12195 = 158535 |
5.2305×1015 | |
|
3 |
9300 |
10752.69 |
15×10753 = 161295 |
5.3196×1015 | |
|
Усреднение Þ |
0.5174×1016 |
1.39×10-8 | |||
Информация о химии
Таубе (Taube), Генри
Канадо-американский химик Генри Таубе родился в Ньюдорфе (провинция Саскачеван, Канада), в семье Альбертины (Тайдетски) Таубе и Самюэла Таубе. Окончив местную школу, он поступил в Саскачеванский университет, где в 1935 г. получил ...
Содди (Soddy), Фредерик
Английский химик Фредерик Содди родился в Истборне. Он был седьмым сыном лондонского купца Бенджамина Содди и Ханны (Грин) Содди. Мальчику было всего два года, когда умерла его мать. Содди вырастила его сводная сестра. У Содди ран ...
Браунер (Brauner), Богуслав
Чехословацкий химик Богуслав Браунер родился в Праге (тогда Австро-Венгрия). Изучал химию в Пражской технической школе у Ф.Столбы. С 1882 г. Браунер читал лекции по химии в Пражском университете; в 1897 г. стал профессором химии. ...