Окислительно-восстановительные реакции (ОВР), их классификация. Важнейшие окислители и восстановители. Составление уравнений ОВР по методу полуреакций. Влияние среды на протекание ОВР
Рефераты по химии / Общая и неорганическая химия / Окислительно-восстановительные реакции (ОВР), их классификация. Важнейшие
окислители и восстановители. Составление уравнений ОВР по методу полуреакций. Влияние
среды на протекание ОВРСтраница 9
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
З. Если в реакции число элементов, изменяющих свою степень окисления, больше двух, то устанавливают общее число электронов, отдаваемых восстановителями, и общее число электронов, присоединяемых окислителями, а в остальном соблюдается общий порядок составления уравнения реакции. Например,
3As3+2S2-3 + 28HN5+O3 + 4H2O ® 6H3As5+O4 + 9H2S6+O4 + 28N2+O
![]()
![]() 2As3+ - 4e ® 2As5+ -28e 3
2As3+ - 4e ® 2As5+ -28e 3
![]() 3S2- - 24 ® 3S6+
3S2- - 24 ® 3S6+
N5+ + 3e ® N2+ +3e 28
4. Оба элемента – и окислитель, и восстановитель – находятся в одной и той же молекуле. Это реакция внутримолекулярного окисления-восстановления и реакции диспропорционирования. Для удобства подбора коэффициентов в этом случае иногда можно рассматривать процесс как бы идущим справа налево. Например,
3HN3+O2 ® HN5+O3 + 2 N2+O + H2O
![]() N3+ + e ® N2+ 2
N3+ + e ® N2+ 2
N3+ - 2e ® N5+ 1
Продукты окислительно-восстановительных реакций устанавливаются опытным путём
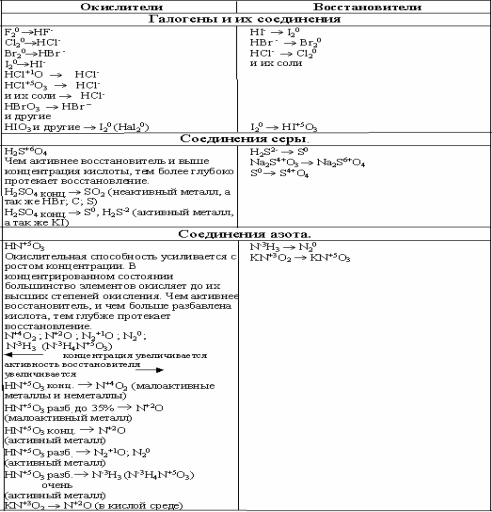
Элементы, имеющие высшую
степень окисления, могут быть только окислителями.
Элементы, имеющие низшую
степень окисления, могут быть только восстановителями.
Элементы, находящиеся в промежуточной
степени окисления, могут и окисляться, и
восстанавливаться, то есть проявляют окислительно-восстановительную двойственностьТипичные окислители
: металлы, соединения неметаллов в низшей степени окисленияТипичные восстановители
: галогены, О2, N2, вещества, содержащие элемент в высшей
СО.
Реакции окисления - восстановления могут протекать в различных средах: в кислой, нейтральной и щелочной. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления. Рассмотрим пример влияния среды на восстановление перманганат- иона MnO4
Классификация ОВР
1. К межмолекулярным
относятся реакции, у которых окислитель и восстановитель находятся в разных веществах.
2. К внутримолекулярным
относятся реакции, которые протекают с изменением степени окисления атомов в одной и той же молекуле.
3. К реакциям диспропорционирования
, или дисмутации (самоокисления-самовосстановления), относятся реакции, сопровождающиеся одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента.
Эти реакции характерны для веществ, содержащих атомы с промежуточной степенью окисления
Информация о химии
Муассан (Moissan), Анри
Французский химик Фердинанд Фредерик Анри Муассан родился в Париже. Его отец был служащим Восточной железнодорожной компании, а мать – портнихой. Когда в 1864 г. семья Муассан переехала в Мо, мальчик поступил в муниципальную ...
Огромная экономия энергии
В США создали материал который способен удешевить производство почти всего на свете. Ученые разработали новую мембрану с нанопорами, способную быстро и точно разделять молекулы в сложных промышленных условиях. Эта технология может ...
Физические методы дегазации воды
В технике водоподготовки для удаления газов (кроме кислорода) в основном применяют пленочные дегазаторы, а для обескислороживания воды — вакуумные дегазаторы или термические деаэраторы. Барботажные дегазаторы использую ...


