Окислительно-восстановительные реакции (ОВР), их классификация. Важнейшие окислители и восстановители. Составление уравнений ОВР по методу полуреакций. Влияние среды на протекание ОВР
Рефераты по химии / Общая и неорганическая химия / Окислительно-восстановительные реакции (ОВР), их классификация. Важнейшие
окислители и восстановители. Составление уравнений ОВР по методу полуреакций. Влияние
среды на протекание ОВРСтраница 6
Вывод: если восстановитель в избытке, то в стандартных условиях вариант 1 термодинамически выгоднее в кислой среде (рН<5,9), вариант 2 - в нейтральной и щелочной (5,9<рН<14,5), а вариант 3 - лишь в очень сильно щелочной среде (рН>14,5).
Окислительно-восстановительные реакции (ОВР) (реакции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении - понижается.
Первоначально окислением называли только реакции веществ с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует.
В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого (окислителя), например:
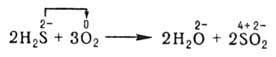
При этом окислитель восстанавливается, а восстановитель - окисляется. При протекании реакций в гальваническом элементе переход электронов осуществляется по проводнику, соединяющему электроды элемента, и изменение энергии Гиббса ДG в данной реакции может быть превращено в полезную работу. В отличие от реакций ионного обмена окислительно-восстановительные реакции (ОВР) в водных растворах протекают, как правило, не мгновенно.
При окислительно-восстановительных реакциях атомы в высшей степени окисления являются только окислителями, в низшей - только восстановителями; атомы в промежуточной степени окисления в зависимости от типа реакции и условий ее протекания могут быть окислителями или восстановителями. Многие окислительно-восстановительные реакции (ОВР) - каталитические По формальным признакам окислительно-восстановительные реакции (ОВР) разделяют на межмолекулярные (например, 2SO2 + O2 → SO3) и внутримолекулярные, например:
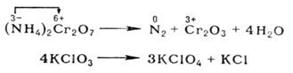
Последняя реакция представляет собой самоокисление-самовосстановление (см. Диспропорционирование).
окислительно-восстановительные реакции (ОВР) часто сопровождаются высоким энерговыделением, поэтому их используют для получения теплоты или электрической энергии. Наиболее энергичные окислительно-восстановительные реакции (ОВР) протекают при взаимодействии восстановителей с окислителями в отсутствие растворителя; в растворах такие реакции могут быть невозможны вследствие окислительно-восстановительного взаимодействия одного или обоих реагентов с растворителем. Так, в водном растворе нельзя непосредственно провести реакцию 2Na + F2 → 2NaF, поскольку натрий и фтор бурно взаимодействуют с водой. На окислительно-восстановительные свойства ионов сильно влияет комплексообразование, например: комплекс [Co2+(CN)6]4-, в отличие от гидратированного иона Со2+, является сильным восстановителем.
В случае окислительно-восстановительных реакций в органической химии использование обобщенной концепции окисления-восстановления и понятия о степени окисления часто малопродуктивно, особенно при незначительно полярности связей между атомами, участвующими в реакции. В органической химии окисление рассматривают обычно как процесс, при котором в результате перехода электронов от органического соединения к окислителю возрастает число (или кратность) кислородсодержащих связей (С — О, N — О, S — О и т.п.) либо уменьшается число водородсодержащих связей (С — Н, N —Н, S —Н и т.п.), например: RCHO → RCOOH; R2CHCHR2 → R2C=CR2. При восстановлении органических соединений в результате приобретения электронов происходят обратные процессы, например: R2CO → R2CH2; RSO2Cl → RSO2H.
Информация о химии
Шанкуртуа (Beguyer de Chancourtois), Александр Эмиль Бегуйе де
Французский геолог и химик Александр Эмиль Бегуйе де Шанкуртуа родился в Париже. После окончания в 1838 г. парижской Высшей Политехнической школы продолжил образование в Горной школе (Ecole des Mines). Закончив её, Шанкуртуа в 184 ...
Циглер (Ziegler), Карл
Немецкий химик-органик Карл Циглер родился в Хельсе, в семье Луизы (Ралл) Циглер и Карла Циглера, лютеранского священника. В 1916 г. он был принят в Марбургский университет, где изучал химию под руководством известного химика-орга ...
Брёнстед (Bronsted), Йоханнес Николаус
Датский физикохимик Йоханнес Николаус Брёнстед родился в Варде. В 1897 г. поступил в Копенгагенский университет; в 1899 г. сдал экзамен на звание инженера, в 1902 г. стал магистром, а в 1908 г. – доктором наук. С 1905 г. раб ...


