Условия возникновения коррозионного процесса
Рефераты по химии / Теоретические основы электрохимической коррозии / Условия возникновения коррозионного процессаСтраница 2
![]() (4)
(4)
Следовательно, поведение корродирующего электрода отвечает поведению обратимого металлического электрода, а установившееся значение компромиссного потенциала близко к равновесному потенциалу соответствующего металлического электрода и должно изменяться с концентрацией ионов металла в соответствии с формулой Нернста.
Изменение рН раствора не влияет при этом заметно на величину стационарного потенциала. Таким образом, здесь стационарный потенциал коррозии сε приводится к обратимому потенциалу металла Мεr (уравнение 5):
сε ≈ Мεr (5)
В качестве примеров таких систем можно привести разложение амальгам и электрохимическое растворение цинка.
Напротив, если ток обмена водорода значительно больше тока обмена металла, то
![]() ,
,
![]()
и, с некоторым приближением, можно получить уравнение 6:
![]() (6)
(6)
Теперь уже компромиссный потенциал близок к потенциалу водородного электрода в данных условиях. Его величина закономерно изменяется с рН и почти не зависит от концентрации ионов металла. Таким образом, здесь стационарный потенциал приводится к потенциалу водородного электрода (уравнение 7):
сε = Нεr (7)
Коррозия железа в слабокислых растворах служит примером подобного рода систем.
Необходимым условием электрохимической коррозии является совмещение на поверхности корродирующего металла реакций ионизации и разряда его ионов с какой-либо другой электродной реакцией, протекающей преимущественно в катодном направлении.
В водных средах, не содержащих иных окислителей, кроме ионов водорода и растворенного кислорода, это условие выполняется в том случае, если равновесный потенциал металла отрицательнее равновесного потенциала водородного или кислородного электродов в растворе данного состава. Добавление к раствору других окислителей с более положительным равновесным потенциалом увеличивает число металлов, способных корродировать. Так, серебро, стойкое в водных растворах не восстанавливающихся кислот, корродирует при добавлении окислителя с потенциалом более положительным, чем равновесный потенциал серебряного электрода.
4 Основы кинетической теории коррозии и ее приложение к коррозии идеально чистых металлов
Протекание процесса растворения металла указывает на то, что в данных условиях скорость ионизации больше скорости разряда его ионов:
![]()
В отсутствии внешнего тока и при условии сохранения неизменной величины потенциала такое соотношение скоростей возможно лишь в том случае, если скорость разряда водородных ионов на ту же величину больше скорости обратного процесса, то есть:
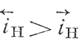
Скорость коррозии iс можно представить как разность между скоростью ионизации и скоростью разряда металлических ионов (уравнение 8) :
![]() (8)
(8)
Поскольку для процесса коррозии справедливо уравнение 3, то вместо уравнения 8 можно написать уравнение 9 и определить скорость коррозии как разницу между скоростями разряда ионов водорода и ионизации его молекул.
![]() (9)
(9)
Это позволяет вычислить скорость коррозионного разрушения металла по данным, относящимся к кинетике реакции выделения и ионизации водорода в коррозионных условиях [1,2].
Информация о химии
Нанокапсулы с витаминами сделают напитки полезнее
Исследователи из Израиля создали из природных пищевых материалов нанокапсулы, которые могут быть загружены жирорастворимыми витаминами и другими липофильными микронутриентами, полезными для здоровья. Полученные нанокапсулы можно ...
Br — Бром
БРОМ (лат. Bromum), Br, химический элемент VII группы периодической системы, атомный номер 35, атомная масса 79,904, относится к галогенам. Природный бром представляет смесь двух нуклидов с массовыми числами 79 (в смеси 50,56% по ...
Ra — Радий
РАДИЙ (лат. Radium), Ra, химический элемент II группы периодической системы, атомный номер 88, атомная масса 226,0254; относится к щелочноземельным металлам. Свойства: радиоактивен; наиболее устойчивый изотоп 226Ra (период полура ...


