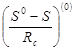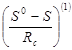Состояния Ли-Кеслера
Рефераты по химии / Энтропия органических веществ при нормальных и повышенных давлениях / Состояния Ли-КеслераСтраница 3
При расчете энтропии органических соединений других классов необходимо учитывать возможность заторможенного вращения прочих структурных фрагментов. Например, в молекулах ароматических углеводородов ось симметрии второго порядка имеют незамещенный фенил (C6H5 -) и пара-фенилен (-С6H4-).
Дать графическую зависимость изотерм и выполнить их анализ. Указать фазовые состояния окиси этилена при рассматриваемых параметрах. Критические температура, давление и ацентрический фактор окиси этилена соответственно равны 469 К, 71 атм и 0,200.
Решение
1. Рассчитываются ![]() при интересующих температурах. Поскольку последние попадают в интервал, рассмотренный в примере 2.4, и на каждом из участков возможна линейная интерполяция теплоемкостей окиси этилена, то корректной будет и линейная интерполяция вычисленных в примере 2.4 значений
при интересующих температурах. Поскольку последние попадают в интервал, рассмотренный в примере 2.4, и на каждом из участков возможна линейная интерполяция теплоемкостей окиси этилена, то корректной будет и линейная интерполяция вычисленных в примере 2.4 значений ![]() . Таким образом, имеем
. Таким образом, имеем
![]() = (288,86–
= (288,86–
274,12)/100×62,8+274,12 = 283,38 Дж/(моль×К).
Аналогично при температурах 304,85, 422,10 и 492,45 К имеем соответственно 243,52, 262,13 и 272,96 Дж/(моль×К).
2. Рассчитываются приведенные температуры:
![]() = 304,85/469 = 0,65;
= 304,85/469 = 0,65; ![]() = 422,10/469 =0,90;
= 422,10/469 =0,90; ![]() = 492,45/469 =1,05;
= 492,45/469 =1,05; ![]() = 562,80/469 = 1,20.
= 562,80/469 = 1,20.
3. При полученных приведенных температурах и значениях приведенных давлений вычисляются значения ![]() c помощью таблиц Ли-Кеслера и рассчитанных величин
c помощью таблиц Ли-Кеслера и рассчитанных величин ![]() .
.
Для ![]() и
и ![]() = 3,55 атм имеем
= 3,55 атм имеем
![]() = 243,52 –
= 243,52 –
( –
ln(1/3,55)+(0,122+0,2×0,309))×8,31441 = 231,5 Дж/(моль×К).
Фрагмент результатов расчета приведен в табл. 2.9 и 2.10, где жирным шрифтом выделены сведения, относящиеся к жидкому состоянию окиси этилена.
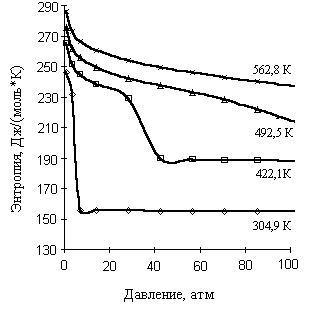
Рис. 2.2. Зависимость энтропии окиси этилена от давления
4. Зависимость ![]() от давления при избранных температурах приведена на рис. 2.2. Характер полученных графических зависимостей различен для изотерм, принадлежащих жидкому и газообразному состояниям вещества. Энтропия жидкости в меньшей степени зависит от давления, чем энтропия газа, что очевидно. Для докритической изотермы резкое изменение энтропии сопряжено с изменением фазового состояния вещества.
от давления при избранных температурах приведена на рис. 2.2. Характер полученных графических зависимостей различен для изотерм, принадлежащих жидкому и газообразному состояниям вещества. Энтропия жидкости в меньшей степени зависит от давления, чем энтропия газа, что очевидно. Для докритической изотермы резкое изменение энтропии сопряжено с изменением фазового состояния вещества.
Таблица 2.9
|
|
при приведенном давлении, |
при приведенном давлении, | ||||||||
|
0,010 |
0,050 |
0,100 |
0,200 |
0,400 |
0,010 |
0,050 |
0,100 |
0,200 |
0,400 | |
|
0,65 |
0,023 |
0,122 |
7,052 |
6,368 |
5,694 |
0,055 |
0,309 |
7,832 |
7,829 |
7,824 |
|
0,90 |
0,009 |
0,046 |
0,094 |
0,199 |
0,463 |
0,013 |
0,068 |
0,14 |
0,301 |
0,744 |
|
1,05 |
0,006 |
0,030 |
0,060 |
0,124 |
0,267 |
0,007 |
0,034 |
0,069 |
0,140 |
0,292 |
|
1,20 |
0,004 |
0,021 |
0,042 |
0,085 |
0,177 |
0,004 |
0,019 |
0,037 |
0,075 |
0,149 |
Информация о химии
Общая химия
О́бщая хи́мия — курс химии в ВУЗах, представляющий собой совокупность ряда разделов неорганической, органической, физической, аналитической химии, а также др. направлений химической науки. Основами современного кур ...
Бартрин
Синонимы: ЭНТ-21557 Брутто-формула (система Хилла): C18H21ClO4 Молекулярная масса (в а.е.м.): 336,82 Растворимость (в г/100 г или характеристика): ацетон: растворим бензол: растворим вода: не растворим Применение:Инсектиц ...
Крукс (Crookes), Уильям
Английский физик и химик Уильям Крукс родился в Лондоне 17 июня 1832 г. В 1848 –1850 гг. учился в Лондонском химическом колледже, после чего с 1850 по 1854 г. работал в колледже в качестве ассистента А.В.Гофмана. После непр ...