Прогнозирование энтропий органических соединений при повышенной температуре
Рефераты по химии / Энтропия органических веществ при нормальных и повышенных давлениях / Прогнозирование энтропий органических соединений при повышенной температуреСтраница 1
При прогнозировании энтропий органических веществ, находящихся при давлении 1 атм и температуре, отличающейся от 298 К, используются:
*
значение ![]() вещества, вычисленное любым из аддитивных методов или взятое из справочников;
вещества, вычисленное любым из аддитивных методов или взятое из справочников;
*
сведения о температурной зависимости теплоемкости вещества в виде аппроксимирующего уравнения или в табулированной форме;
* уравнение (2.4) для расчета температурной зависимости энтропии.
Процедура расчета иллюстрируется примером 2.4, при этом использованы справочные данные для теплоемкостей вещества, поскольку вопросы прогнозирования ![]() обсуждаются позже (разд. 3 данного пособия).
обсуждаются позже (разд. 3 данного пособия).
Пример:
Рассчитать ![]() окиси этилена при 400, 500 и 600 К. Энтропия
окиси этилена при 400, 500 и 600 К. Энтропия ![]() окиси этилена составляет 242,4 Дж/(моль×К) [1], значения теплоемкостей C0p,T при 400, 500 и 600 К заимствованы из [1] и приведены в табл. 2.6.
окиси этилена составляет 242,4 Дж/(моль×К) [1], значения теплоемкостей C0p,T при 400, 500 и 600 К заимствованы из [1] и приведены в табл. 2.6.
Решение:
С использованием уравнения (2.4) вычисляются энтропиии окиси этилена при интересующих температурах. При этом средние величины теплоемкостей окиси этилена считаются величинами постоянными для каждого из температурных диапазонов (от 300 до 400, от 400 до 500 и от 500 до 600 К) по условию создания таблиц, допускающему линейную интерполяцию соседних значений в них.
Результаты расчета приведены ниже и в табл. 2.6 сопоставлены с рекомендуемыми значениями [1].
![]() = 242,74+(48,53+62,55)/2·(ln400 –
= 242,74+(48,53+62,55)/2·(ln400 –
ln300) = 258,72 Дж/(моль×К);
![]() = 258,72+(62,55+75,44)/2·(ln500 –
= 258,72+(62,55+75,44)/2·(ln500 –
ln400) = 274,12 Дж/(моль×К);
![]() = 274,12 +(75,44+86,27)/2·(ln600 –
= 274,12 +(75,44+86,27)/2·(ln600 –
ln500) = 288,86 Дж/(моль×К).
Температурная зависимость ![]() иллюстрируется рис. 2.1.
иллюстрируется рис. 2.1.
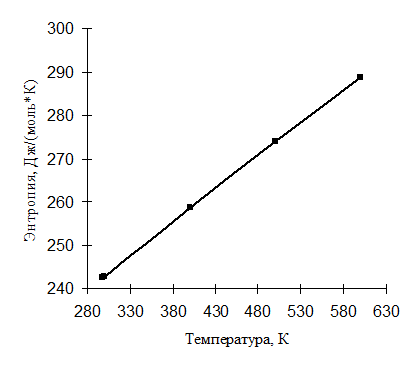
Рис. 2.1. Зависимость идеально-газовой энтропии окиси этилена от температуры
Таблица 2.6
|
Т, К |
|
|
|
Погрешность, % отн. |
|
298 |
242,42 |
48,28 | ||
|
300 |
242,76 |
48,53 |
242,74 |
0,00 |
|
400 |
258,65 |
62,55 |
258,72 |
0,03 |
|
500 |
274,01 |
75,44 |
274,12 |
0,04 |
|
600 |
288,78 |
86,27 |
288,86 |
0,03 |
Информация о химии
Винклер (Winkler), Клеменс Александр
Немецкий химик Клеменс Александр Винклер родился во Фрейберге; его отец был химиком-металлургом. После окончания реального училища в Дрездене и ремесленной школы в Хемнице Винклер поступил во Фрейбергскую горную академию, которую ...
Бройль (de Broglie), Луи Виктор Пьер Раймон де
Французский физик Луи Виктор Пьер Раймон де Бройль родился в Дьеппе. Он был младшим из трех детей Виктора де Бройля и урожденной Полин де ля Форест д'Армайль. Как старший мужчина этой аристократической семьи, его отец носил титул ...
Органическая химия
Органи́ческая хи́мия — раздел химии, изучающий соединения углерода, их структуру, свойства, методы синтеза.[1] Органическими называют соединения углерода с другими элементами. Наибольшее количество соединений углер ...


