Получение гидроксида натрия
Рефераты по химии / Получение гидроксида натрияСтраница 2
В летнее время происходит испарение воды с поверхности озер, и поваренная соль выпадает в виде кристаллов. Такая соль называется самосадочной. В морской воде содержится до 35 г/л хлорида натрия. В местах с жарким климатом, где происходит интенсивное испарение воды, образуются концентрированные растворы хлорида натрия, из которых он кристаллизуется. В недрах земли, в пластах соли протекают подземные воды, которые растворяют NaCl и образуют подземные рассолы, выходящие через буровые скважины на поверхность.
Растворы поваренной соли, независимо от пути их получения содержат примеси солей кальция и магния и до того, как они передаются в цеха электролиза, подвергаются очистке от этих солей. Очистка необходима потому, что в процессе электролиза могут образовываться плохо растворимые гидроокиси кальция и магния, которые нарушают нормальный ход электролиза.
Очистка рассолов производится раствором соды и известковым молоком. Помимо химической очистки, растворы освобождаются от механических примесей отстаиванием и фильтрацией.
Электролиз растворов поваренной соли производится в ваннах с твердым железным (стальным) катодом и с диафрагмами и в ваннах с жидким ртутным катодом. В любом случае промышленные электролизеры, применяемые для оборудования современных крупных хлорных цехов, должны иметь высокую производительность, простую конструкцию, быть компактными, работать надежно и устойчиво.
Электролиз растворов хлористого натрия в ваннах со стальным катодом и графитовым анодом
.
Дает возможность получать гидроксид натрия, хлор и водород в одном аппарате (электролизере). При прохождении постоянного электрического тока через водный раствор хлорида натрия можно ожидать выделения хлора:
2CI- — 2е Þ С12 (а)
а также кислорода:
20Н- - 2е Þ 1/2О2 + Н2О (б)
или
H20-2eÞ1/2О2 + 2H+
Нормальный электродный потенциал разряда ОН--ионов составляет + 0,41 в, а нормальный электродный потенциал разряда ионов хлора равен + 1,36 в. В нейтральном насыщенном растворе хлористого натрия концентрация гидроксильных ионов около 1 ·10-7 г-экв/л. При 25° С равновесный потенциал разряда гидроксильных ионов будет

Равновесный потенциал разряда, ионов хлора при концентрации NaCI в растворе 4,6 г-экв/л равен
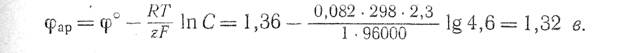
Следовательно, на аноде с малым перенапряжением должен в первую очередь разряжаться кислород.
Однако на графитовых анодах перенапряжение кислорода много выше перенапряжения хлора и поэтому на них будет происходить в основном разряд ионов С1- с выделением газообразного хлора по реакции (а).
Выделение хлора облегчается при увеличении концентрации NaCI в растворе вследствие уменьшения при этом величины равновесного потенциала. Это является одной из причин использования при электролизе концентрированных растворов хлорида натрия, содержащих 310—315 г/л.
На катоде в щелочном растворе происходит разряд молекул воды по уравнению
Н20 + е = Н + ОН- (в)
Атомы водорода после рекомбинации выделяются в виде молекулярного водорода
2Н Þ Н2 (г)
Разряд ионов натрия из водных растворов на твердом катоде невозможен вследствие более высокого потенциала их разряда по сравнению с водородом. Поэтому остающиеся в растворе гидроксид - ионы образуют с ионами натрия раствор щелочи.
Процесс разложения NaCI можно выразить таким образом следующими реакциями:
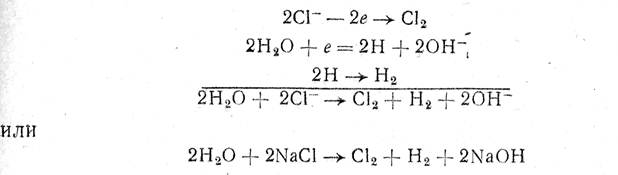
т. е. на аноде идет образование хлора, а у катода — водорода и гидроксида натрия.
При электролизе, наряду с основными, описанными процессами, могут протекать и побочные, один из которых описывается уравнением (б). Помимо этого, хлор, выделяющийся на аноде, частично растворяется в электролите и гидролизуется по реакции
![]()
В случае диффузии щелочи (ионов ОН-) к аноду или смещения катодных и анодных продуктов хлорноватистая и соляная кислоты нейтрализуются щелочью с образованием гипохлорита и хлорида натрия:
НОС1 + NaOH = NaOCl + Н20
НС1 + NaOH = NaCl + Н20
Ионы ClO- на аноде легко окисляются в ClO3-. Следовательно, из-за побочных процессов при электролизе будут образовываться гипохлорит, хлорид и хлорат натрия, что приведет к снижению выхода по току и коэффициента использования энергии. В щелочной среде облегчается выделение кислорода на аноде, что также будет ухудшать показатели электролиза.
Чтобы уменьшить протекание побочных реакций, следует создать условия, препятствующие смешению катодных и анодных продуктов. К ним относятся разделение катодного и анодного пространств диафрагмой и фильтрация электролита через диафрагму в направлении, противоположном движению ОН -ионов к аноду. Такие диафрагмы называются фильтрующими диафрагмами и выполняются из асбеста.
Информация о химии
Рауль (Raoult), Франсуа Мари
Французский химик Франсуа Мари Рауль родился в Фурн-ан-Веп, Нормандия. Первоначальное образование получил в Лионской коллегии; учился в Парижском университете. С 1853 г. был учителем в Реймском лицее, затем в колледже в Сен-Дье, а ...
Карле (Karle), Джером
Американский химик Джером Карле родился в Нью-Йорке, в семье Луиса Карле и Сэйди (Кан) Карфанкл. Он вырос в Бруклине и окончил там в 1933 г. среднюю школу Авраама Линкольна. Потом Карле учился в нью-йоркском Сити-колледже, где поз ...
Пруст (Proust), Жозеф Луи
Французский химик Жозеф Луи Пруст родился в небольшом городке Анжере в семье аптекаря. Получив химическое образование в Парижском университете, в 1775 г. он был назначен на должность управляющего аптекой больницы Сальпетриер. В 17 ...


